手性DMAP-N-O催化羧酸酯的动态动力学拆分:合成萘普生
光学活性的α-芳基-α-烷基羧酸及其衍生物是重要的生物活性分子。(S)-布洛芬、(S)-萘普生、(S)-酮基布洛芬、(S)-菲诺洛芬和(S)-氟比洛芬(图1)是广泛使用的非甾体类抗炎药。因此,需要发展有效的方法来合成手性α-芳基-α-烷基羧酸及其衍生物。
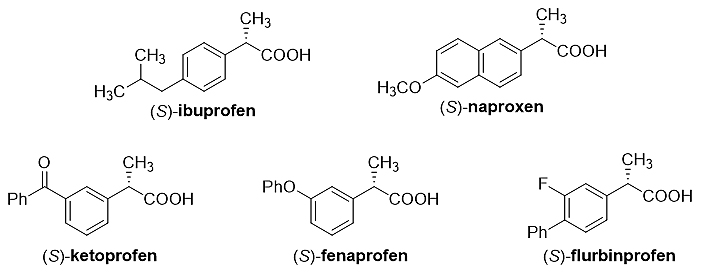
图1. (S)-萘普生等非甾体类抗炎药。图片来源:ACS. Catal.
构建手性α-芳基-α-烷基羧酸衍生物的有效途径是过渡金属催化取代苯乙烯的不对称氢甲酰化及α,β-不饱和酸的不对称氢化。另一种方法则是对芳基烷基联烯酮的不对称加成。奎宁衍生物C1、手性氮杂二茂铁C2、4-二甲氨基吡啶(DMAP)C3、氮杂卡宾(NHC)C4和C5等亲核催化剂分别由Pracejus、Fu、叶松教授和Smith课题组成功地用于该类反应(图2a),但芳基烷基联烯酮稳定性较差。Shiina和Birman课题组分别使用BTM C6和HBTM C7实现了外消旋羧酸的动力学拆分(KR)或动态动力学拆分(DKR),但需添加酸酐或DCC作为活化剂(图2b)。2016年,池永贵教授课题组开创性地报道了手性氮杂卡宾C8催化羧酸酯的动态动力学拆分(J. Am. Chem. Soc., 2016, 138, 7212)用于合成手性α-芳基-α-烷基羧酸酯,并取得了优异的结果(图2c)。但是,上述亲核催化剂均是以氮或碳作为亲核位点,本研究报道了以氧作为亲核位点的动态动力学拆分(图2d)。
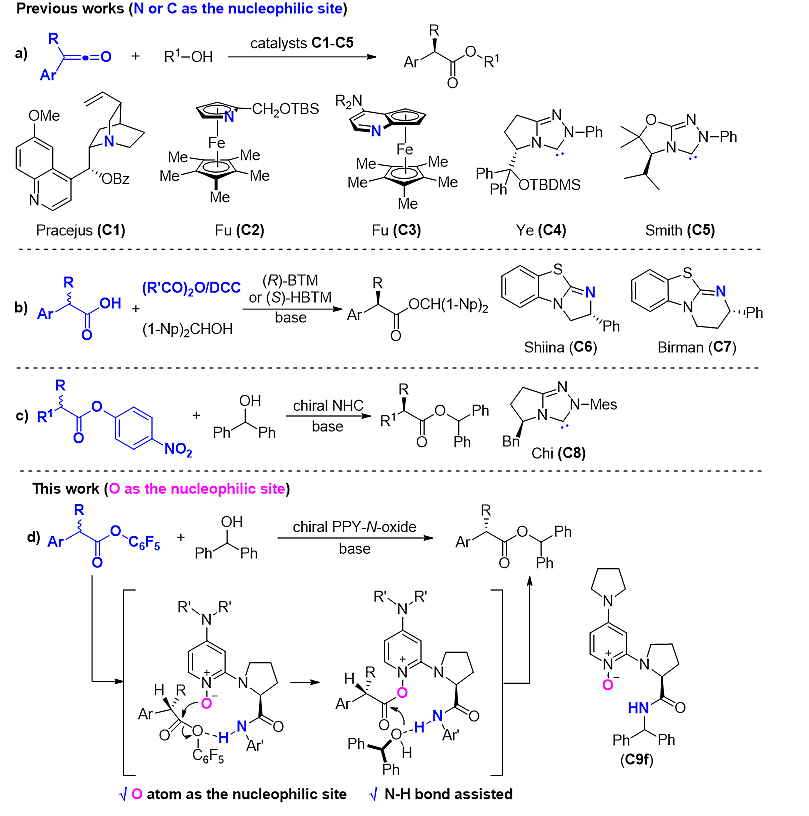
图2. 研究背景及本文工作。图片来源:ACS. Catal.
河南师范大学郭海明课题组在2019年发展了手性3-取代DMAP-N-O酰基转移催化剂(Angew. Chem. Int. Ed., 2019, 58, 2839),并且在2020年又报道了手性2-取代DMAP-N-O作为酰基转移催化剂(J. Am. Chem. Soc., 2020, 142, 19226)。基于以上研究成果,近日,郭海明课题组与擅长理论计算的成都中医药大学的田寅副教授合作,为丰富羧酸酯动态动力学拆分的催化体系,进一步探索手性DMAP-N-O的应用,他们提出将手性2-取代DMAP-N-O用于羧酸酯的动态动力学拆分中,以合成非甾体抗炎药物(图3)。
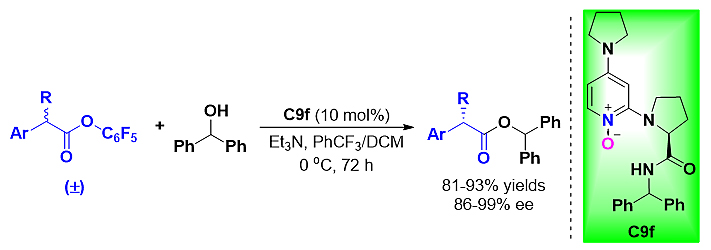
图3. 手性2-取代DMAP-N-O用于羧酸酯的动态动力学拆分。图片来源:ACS. Catal.
基于该催化体系,合成了非甾体抗炎药物分子及其酯衍生物(图4),包括 (S)-布洛芬酯3m、(S)-酮基布洛芬酯3n、(S)-菲诺洛芬酯3o、(S)-氟比诺芬酯3p和(S)-萘普生酯3q,产率为84-93%,ee值为88-94%。通过对(S)-萘普生酯3q进行氢化可以得到药物分子(S)-萘普生4q且对映选择性能够保持,ee值为93%。
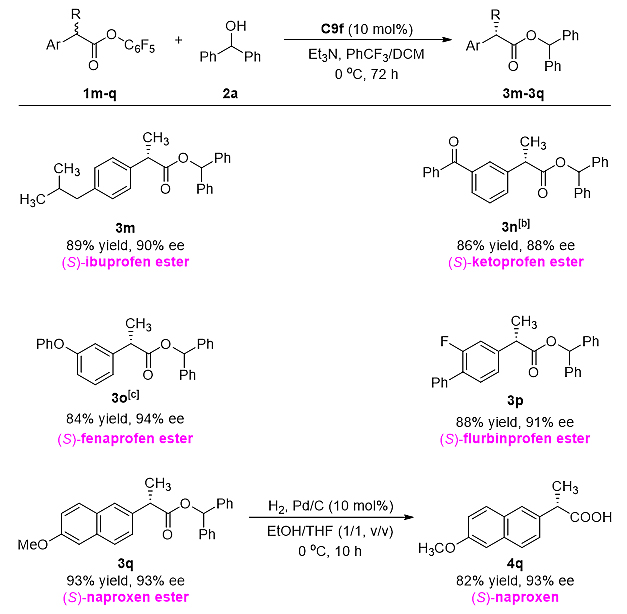
图4. 合成非甾体抗炎药物分子及其衍生物。图片来源:ACS. Catal.
该催化体系能够在克级规模上合成(S)-萘普生酯,并且反应活性和对映选择性均得以保持。产物重结晶后,能够以>99%的ee值得到(S)-萘普生酯。催化剂可回收使用,催化活性和对映选择性也可以保持(图5)。
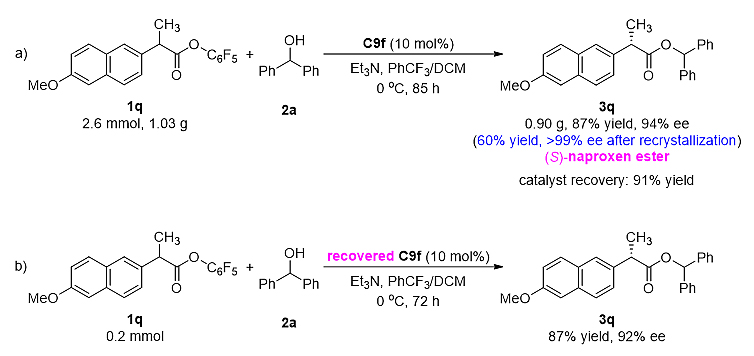
图5. 克级规模合成及催化剂回收使用。图片来源:ACS. Catal.
在机理研究方面,通过将吡啶氮氧还原以及酰胺N−H甲基化后,产物的产率和ee值都急剧下降,说明了该催化剂中吡啶氮氧的氧作为亲核位点,酰胺N−H起到了氢键给体的作用。通过高分辨质谱和核磁共振分析发现,该反应过程中可能存在O-酰基吡啶正离子中间体。立体控制实验证明(S)-底物异构体与手性催化剂更匹配。外消旋化实验表明,在三乙胺存在下有两种不同的原位消旋途径,即五氟苯酚酯的直接烯醇化和O-酰基吡啶盐的烯醇化,而后者速率更快(图6)。动力学实验表明,醇与O-酰化吡啶正离子的亲核取代是该反应的决速步骤。
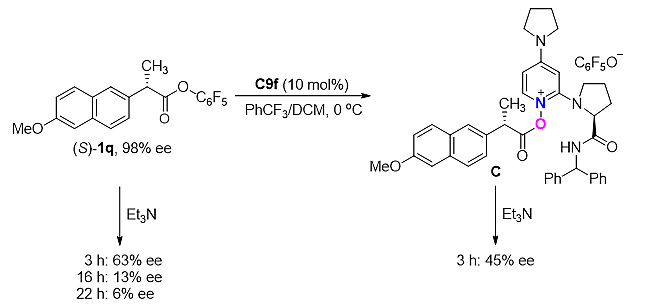
图6. 机理研究实验。图片来源:ACS. Catal.
基于以上实验结果,作者还通过量子化学方法详细地研究了该反应的机制。首先采用象限法分析了手性催化剂的活性区域,如图7左上角部分所示,象限分析法说明,第Ⅱ象限为催化剂的高活性区域,所以底物倾向于从第Ⅱ象限接近催化剂。反应路径分析可知这是两步反应过程,如图7所示,由于第二步反应的能垒更高,所以其为该反应的决速步骤。
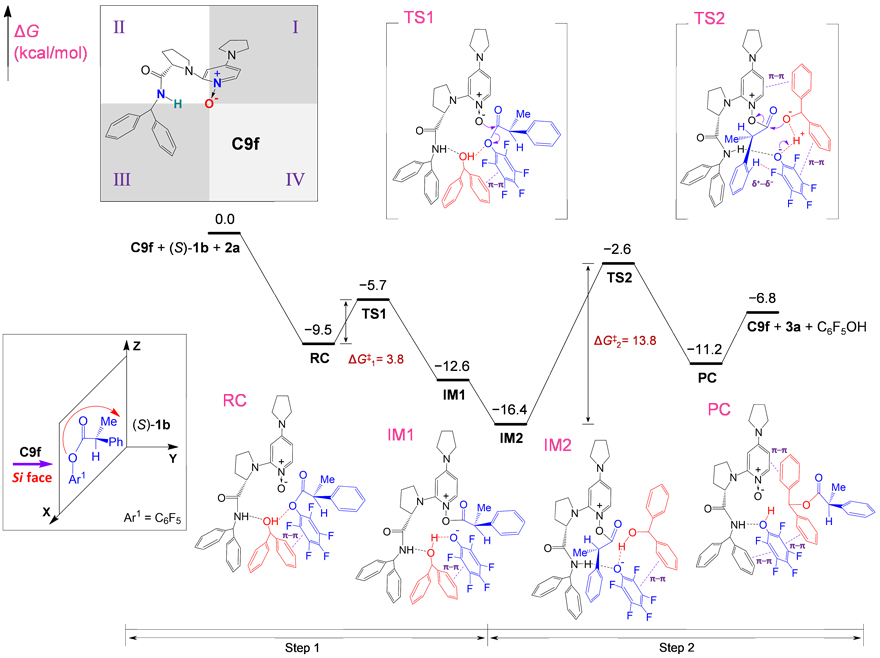
图7. 量子化学方法反应机制研究。图片来源:ACS. Catal.
为了阐明立体选择性的起源,作者细致地分析了该反应的对映体决定过渡态。如图8e下半部分所示,手性催化剂C9f可以从底物分子的Si面和Re面两个方向发起进攻。通过对这两种情况下对映体决定过渡态TS2的详细计算发现,当手性催化剂C9f从底物分子的Si面进攻时,如图8a和8b,(Si,S)-TS2的自由能低于(Si,R)-TS2,说明Si面进攻更加有利于S构型产物生成;然而,当手性催化剂C9f从底物分子的Re面进攻时,如图8c和8d,(Re,S)-TS2的自由能却高于(Re,R)-TS2,说明Re面进攻更加有利于R构型产物生成。但是,进攻方向不同会引起手性催化剂和底物接触面化学微环境的差异,从而导致Si面进攻对应过渡态 (Si,S)-TS2 和 (Si,R)-TS2的自由能均低于Re面进攻对应过渡态 (Re,S)-TS2 和 (Re,R)-TS2,如图8e上半部分所示。以上计算结果表明,手性催化剂的优势进攻方向为底物分子的Si面,并且该反应的优势产物为S构型。此外,该研究还说明:如果不充分考虑手性催化剂对于底物各种可能的进攻方向,有可能会导致计算结果的定性错误。
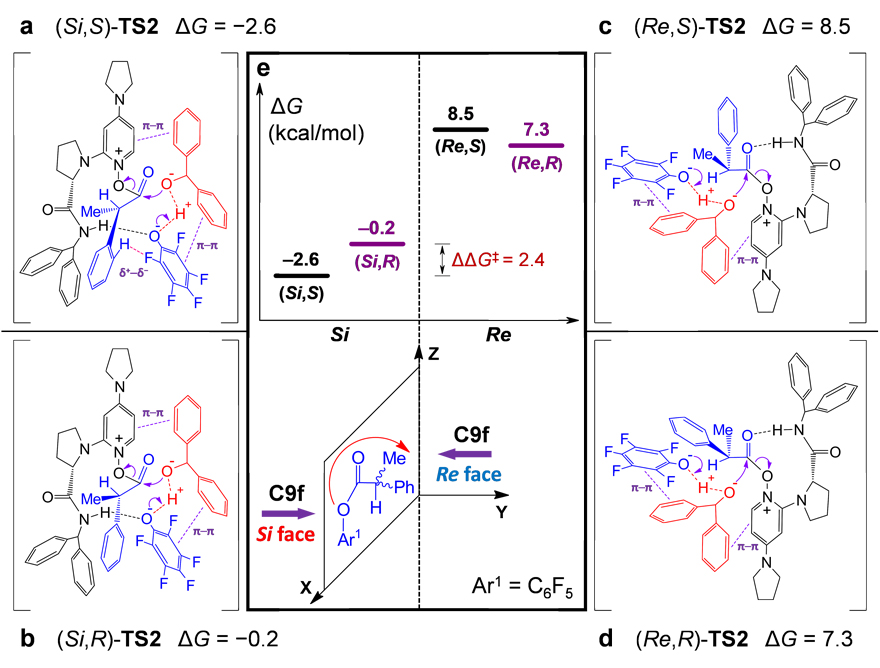
图8. 理论计算。图片来源:ACS. Catal.
因此,该研究通过实验及详细的理论计算,深入阐述了反应机理。如图9所示,在Et3N存在下,五氟苯酚酯1b可以通过酮和烯醇式的互变原位消旋化。对于五氟苯酚酯(S)-1b,催化剂C9f对(S)-1b的亲核进攻生成O-酰基吡啶盐中间体(S,S)-D。二苯甲醇2a的加入经相对自由能为−2.6 kcal/mol的过渡态,发生亲核取代生成产物(S)-3a。对于五氟苯酚酯(R)-1b,由于手性碳上苯基的氢原子与五氟苯酚负离子中氟原子之间缺少δ+-δ-相互作用,相应的过渡态表现出较高的相对自由能(−0.2 kcal/mol),从而使反应速率变慢。在Et3N存在下,(R)-1b和O-酰基吡啶盐中间体(R,S)-D分别原位消旋化,生成(S)-1b和中间体(S,S)-D,再参与反应,使(S)-3a成为主要产物。
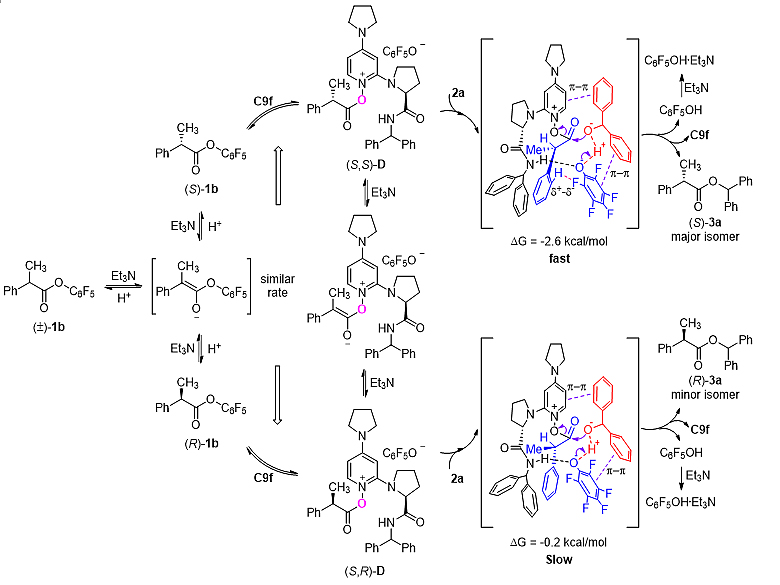
图9. 可能的反应机理。图片来源:ACS. Catal.
这一成果近期发表在ACS Catalysis上,文章第一作者是河南师范大学的谢明胜副教授,实验部分主要由河南师范大学硕士研究生李宁完成,理论计算部分主要由成都中医药大学药学院的田寅副教授完成,郭海明教授、谢明胜副教授和田寅副教授为本文共同通讯作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dynamic Kinetic Resolution of Carboxylic Esters Catalyzed by Chiral PPY-N-oxides: Synthesis of Nonsteroidal Anti-Inflammatory Drugs and Mechanistic Insights
Ming-Sheng Xie,* Ning Li, Yin Tian,* Xiao-Xia Wu, Yun Deng, Gui-Rong Qu, and Hai-Ming Guo*
ACS Catal., 2021, 11, 8183-8196, DOI: 10.1021/acscatal.1c01438
导师介绍
郭海明
https://www.x-mol.com/university/faculty/20138
https://www.htu.edu.cn/hxxy/_t251/2011/0105/c3516a46609/page.htm
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
手性2-取代DMAP转化为DMAP-N-O带来的新机遇 2020-11-16
-
从手性DMAP到DMAP-N-O带来的新发现 2019-04-07
-
烯烃区域选择性的硼化氟甲基化反应 2019-06-26
-
河南师范大学郭海明教授课题组近年来工作总结 2019-11-12


































 京公网安备 11010802027423号
京公网安备 11010802027423号