浙工大葛璟燕课题组JACS:IGF2融合溶酶体靶向嵌合体iLYTAC
近期,浙江工业大学生物工程学院葛璟燕课题组、新加坡国立大学Yao Shao Q.教授、大连理工大学都书博教授联合开发了基于IGF2融合蛋白的溶酶体靶向蛋白降解新技术iLYTAC。相关成果发表于权威期刊Journal of the American Chemical Society。
靶向蛋白降解(Targeted Protein Degradation, TPD)技术是目前药物研究领域中备受瞩目的新兴技术之一。它突破了传统小分子需强结合位点的需求,可有效靶向降解一些传统抑制剂“不可成药”的靶点。诺贝尔奖得主Bertozzi课题组在2020年首次提出多糖构建的溶酶体靶向嵌合体(LYTAC),为40%的胞外蛋白的降解开辟了道路。随后,许多研究团队相继开发了一系列基于细胞内吞-溶酶体机制的膜蛋白降解策略,在靶向各种“不可成药”蛋白上展现出巨大的潜力,然而,内吞受体的配体多是外源物,糖类合成、抗体工程复杂,稳定性也有待提高。
LYTAC的溶酶体靶向受体(LTR)是CI-M6PR,也被称为胰岛素样生长因子-2受体(IGF2R),不仅可识别甘露糖-6-磷酸(M6P),也可以与胰岛素样生长因子2(IGF2),并以高亲和力结合,进入溶酶体,从而维持IGF2的水平。本文基于此现象,课题组利用IGF2作为LTR(IGF2R)的配体,构建了两类IGF2融合的重组蛋白iLYTACs,且成功展示其降解细胞外和细胞膜上蛋白的能力,包括表皮生长因子受体酪氨酸激酶(EGFR)、程序性死亡配体1(PD-L1)、α-突触核蛋白(α-Syn)和B淋巴细胞抗原CD20(图1)。
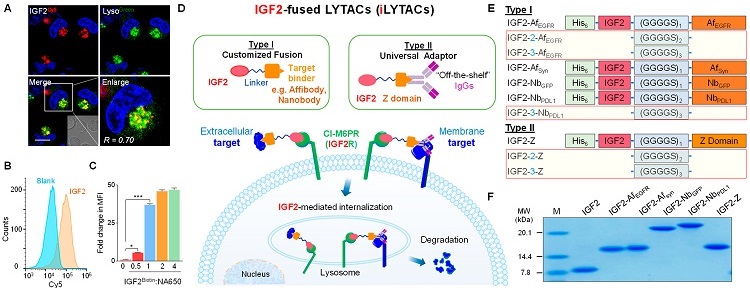
图1. iLYTAC技术用于膜蛋白靶向降解示意图
本文共设计并表达了四种I型iLYTAC(IGF2-AfEGFR、IGF2-AfSyn、IGF2-NbGFP及IGF2-NbPDL1)和II型iLYTAC(IGF2-Z)。其中,亲和体、纳米体具有尺寸小、稳定性和溶解度好、易生产、特异性高和免疫原性低等特性,是抗体的优秀替代品。所有蛋白均在大肠杆菌表达体系表达,且通过SDS-PAGE和质谱确定了蛋白纯度和大小。随后,利用荧光标记融合蛋白,通过细胞成像和流式细胞术验证iLYTAC能够被细胞摄取,且与溶酶体共定位。也通过生物膜干涉技术及细胞摄取实验研究了IGF2及iLYTAC的结合活性,结果也表明亲和体及纳米抗体的融合、不同的GGGGS的链长并没有对结合力产生很大影响。
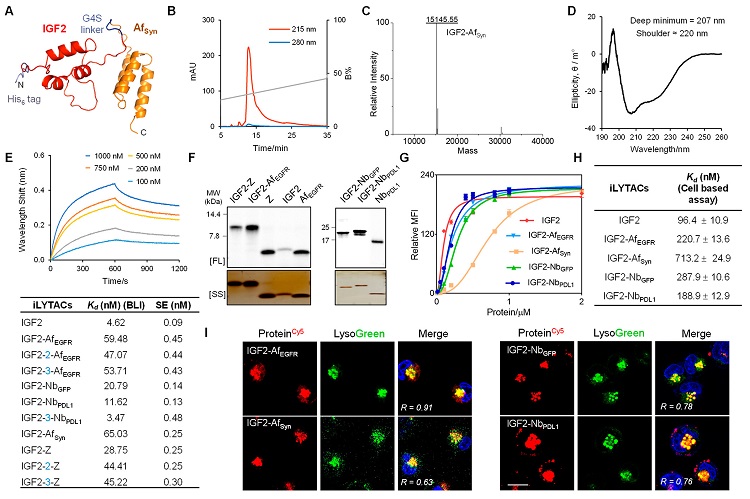
图2. iLYTAC的制备及表征
接下来,作者探索了I型iLYTACs对细胞膜上(EGFR\PD-L1)和细胞膜外(GFP\α-Syn)的降解效率。如,IGF2-AfEGFR处理后,EGFR在细胞膜上的EGFR转移到了细胞内,且WB结果显示,细胞中EGFR水平的降低呈现时间、浓度依赖(图3)。IGF2- fα-Syn对神经退行性疾病相关蛋白α-Syn也降解比较明显。
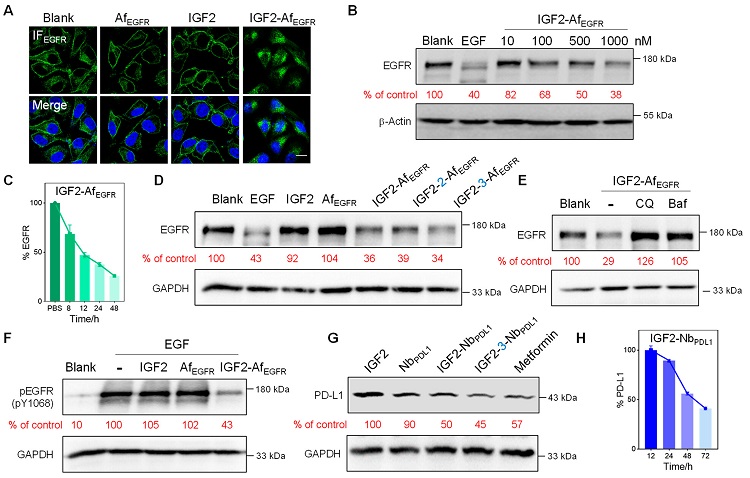
图3. I型iLYTAC的应用
而II型iLYTACs则是由IGF2与抗体恒定区Fc的结合的Z domain融合表达,可用于结合靶蛋白的IgG抗体(如已有的商业化抗体),具有普适性、可高通量筛选抗体药物等特性。同样以EGFR的单抗药物西妥昔单抗(Cet)为例,IGF2-Z能够将抗体带入到细胞中并定位溶酶体。WB结果也说明,Cet在与IGF2-Z联合给药时,能够降低细胞中EGFR的表达水平。

图4. II型iLYTAC的应用
最后,通过使用HeLa细胞裸鼠皮下移植瘤模型,评估了(IGF2-Z + Cet)和 IGF2-AfEGFR对治疗小鼠的抗肿瘤作用。以Cet、AfEGFR或IGF2-Z处理作为对照。IGF2-Z + Cet处理的小鼠肿瘤重量下降了近50%,而IGF2-AfEGFR处理的小鼠肿瘤重量变化较小。进一步WB分析肿瘤中EGFR表达水平,结果显示,肿瘤两类iLYTACs的处理能显著降低肿瘤中EGFR的水平。该研究结果也表明iLYTACs能够提升EGFR靶向耐药型肿瘤的治疗效果。
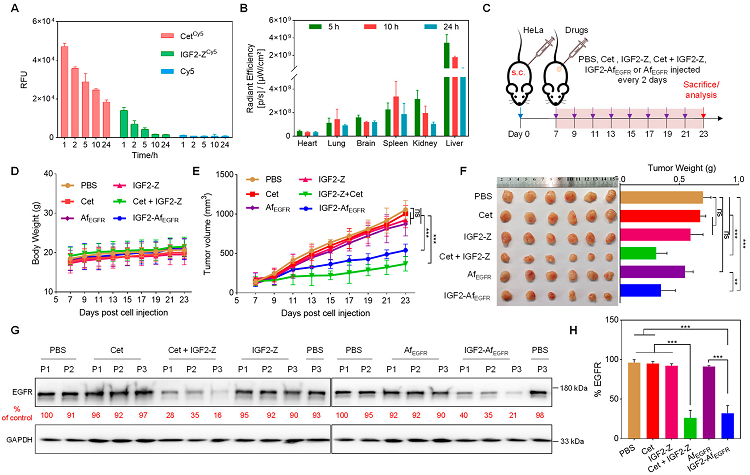
图5. 两类iLYTACs在肿瘤模型上的应用
总之,本文成功报道了重组嵌合IGF2融合蛋白,用于降解细胞外蛋白和膜蛋白。该策略便捷、有效、且可以通用化、模块化,为膜蛋白及膜外蛋白的药物开发、抗体药物的改善、耐药性的降低等等提供了强有力的工具,为重组蛋白类溶酶体靶向蛋白降解平台的设计开辟了新思路。当然,作者也提到一些相关缺点,如体内代谢快、降解周期相对长,仍需在后续工作中深化。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Insulin-like Growth Factor 2 (IGF2)-Fused Lysosomal Targeting Chimeras for Degradation of Extracellular and Membrane Proteins
Bei Zhang, Rajeev Kungur Brahma, Liquan Zhu, Jiayi Feng, Shiqi Hu, Linghui Qian, Shubo Du*, Shao Q. Yao*, and Jingyan Ge*
J. Am. Chem. Soc., 2023, 145, 24272–24283, DOI: 10.1021/jacs.3c08886
研究团队简介

葛璟燕,教授,博士生导师。先后毕业于浙江大学(本科)、新加坡国立大学(博士)。现为浙江工业大学生物工程学院教授。课题组近年来在Acc. Chem. Res.、J. Am. Chem. Soc.、ACS Cent. Sci.、ACS Chem. Biol.等国际知名期刊发表40余篇。入选浙江省“特聘专家”、浙江省中青年学科带头人、浙江省“高校领军人才培养计划”高层次拔尖人才。课题组专注于化学与生命科学的前沿交叉研究,着力构筑适用于“原位”研究蛋白质功能的分子工具,实现在分子层面上对蛋白质(组)的精准探测和调控。欢迎感兴趣的博士后和研究生联系并申请加入。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
利用蛋白生物效应器合理设计多功能分子 2022-06-26
-
蛋白质降解技术:药物发现的战略式转变 2021-09-21
-
高效可口服的靶向蛋白降解嵌合体用于治疗晚期前列腺癌 2021-10-04
-
苏州大学刘庄、上海交大杨宇/韩达:共价LYTAC介导的免疫检查点降解(ICD)疗法 2023-11-15
-
Methylarginine targeting chimeras for lysosomal degradation of intracellular proteinsLaurence J. Seabrook, Carolina N. Franco, Cody A. Loy, Jaida Osman, Callie Fredlender, Jan Zimak, Melissa Campos, Steven T. Nguyen, Richard L. Watson, Samantha R. Levine, Marian F. Khalil, Kaelyn Sumigray, Darci J. Trader, Lauren V. Albrecht
-
Targeting insulin-like growth factor 2 mRNA-binding proteins (IGF2BPs) for the treatment of cancerEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-02-15 ,DOI:10.1016/j.ejmech.2024.116241Yuanqian Cai, Yingzhe Wang, Bingjie Mao, Qidong You, Xiaoke Guo


































 京公网安备 11010802027423号
京公网安备 11010802027423号