铂配合物调节肿瘤能量代谢和免疫微环境的新策略:抑制乳酸脱氢酶
铂类抗肿瘤药物是临床治疗各种恶性肿瘤的主要化疗药物,其主要缺点是容易诱发耐药性和系统毒性。四价铂配合物是潜在的新型抗肿瘤药物,化学惰性较强,其轴向配体易于被修饰,有望克服现有二价铂类抗肿瘤药物的缺点。肿瘤细胞的能量代谢不同于正常细胞,优先选择有氧糖酵解而非氧化磷酸化(OXPHOS)作为葡萄糖代谢的途径。肿瘤细胞会增加葡萄糖摄取,将大量丙酮酸转化为乳酸,通过合成代谢促进肿瘤细胞增殖并避免凋亡,该现象称为“Warburg效应”,又称为有氧糖酵解。有氧糖酵解产生的乳酸进入肿瘤微环境(TME)使其呈酸性,抑制抗肿瘤免疫反应,尤其影响免疫细胞的活性并参与肿瘤免疫逃逸,促进肿瘤形成与发展。例如乳酸通过稳定缺氧诱导因子-1α(HIF-1α)诱导巨噬细胞选择性极化,增加血管内皮生长因子(VEGF)和L-精氨酸代谢酶(ARG)的产生,从而形成免疫抑制性TME。此外,乳酸还作用于内皮细胞,间接促进M2型肿瘤相关巨噬细胞(TAM)编程,诱导肿瘤血管生成(angiogenesis)。
乳酸脱氢酶(LDH)由LDHA和LDHB组成,是糖酵解过程中催化丙酮酸转化为乳酸的限速酶。LDHA在肿瘤中表达上调,并与肿瘤细胞的侵袭性相关;LDHB在所有细胞中均有表达。由于乳酸脱氢酶是细胞中催化乳酸产生的关键酶,可协助肿瘤细胞摄取葡萄糖生成乳酸,因此抑制乳酸生成是调控肿瘤能量代谢和免疫抑制性TME的重要方法。
单羧酸转运蛋白家族(MCTs)参与乳酸的跨膜转运,促进肿瘤代谢重编程,其中MCT1对乳酸具有较高的亲和力,根据乳酸浓度的变化协助其内流或外排,而MCT4主要促进糖酵解活跃细胞内乳酸的外排。基质细胞通过MCT4外排的乳酸会被肿瘤细胞经MCT1吸收,并在LDHB协助下转化为丙酮酸,重新用于ATP合成,为快速增殖的肿瘤细胞提供所需的能量,抵消药物作用,此即为“反Warburg效应”,是一种新发现的能量代谢机制。抑制乳酸脱氢酶或单羧酸转运蛋白都可以减少肿瘤细胞内乳酸聚积,有利于肿瘤治疗。
非甾体抗炎药双氯芬酸(DCF)在肿瘤治疗中有多种潜在用途,包括通过抑制LDH降低葡萄糖摄取和乳酸分泌,削弱Warburg效应,以及抑制MCT1和MCT4表达,减少乳酸内流或外排等。近日,南京大学王晓勇教授(点击查看介绍)课题组利用抗肿瘤药顺铂(CDDP)和DCF设计了两个新颖的能量代谢免疫调节剂MDP和DDP(图1),它们不仅对肿瘤细胞表现出较强的抗增殖活性,还能通过抑制乳酸脱氢酶调节肿瘤糖代谢和免疫微环境,抑制肿瘤血管生成,从而为抑制肿瘤生长提供了一条新途径。
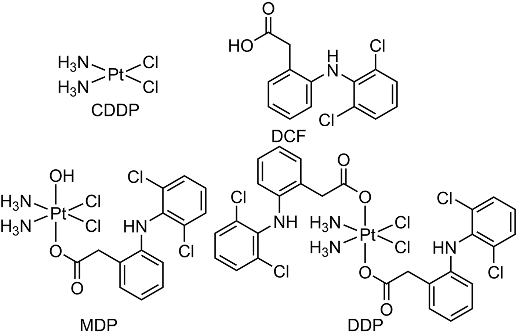
图1. MDP和DDP的化学结构
首先,MDP和DDP对人卵巢癌细胞(SKOV-3)等多种肿瘤细胞具有很强的抗增殖活性(表1),可以通过损伤DNA和抑制DNA修复,诱导肿瘤细胞凋亡。动物试验表明,DDP可使肿瘤体积减少70.4%,具有较高的体内抗肿瘤活性(图2),而且系统毒性较低。
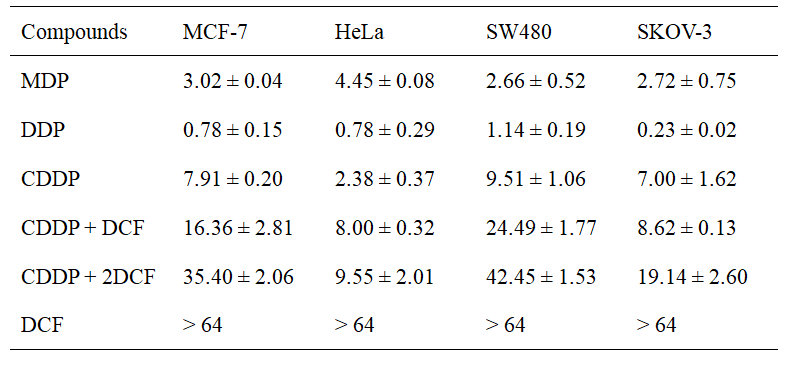
表1. DDP、MDP、CDDP、DCF、CDDP + DCF对不同肿瘤细胞的IC50(μM)值(48小时)
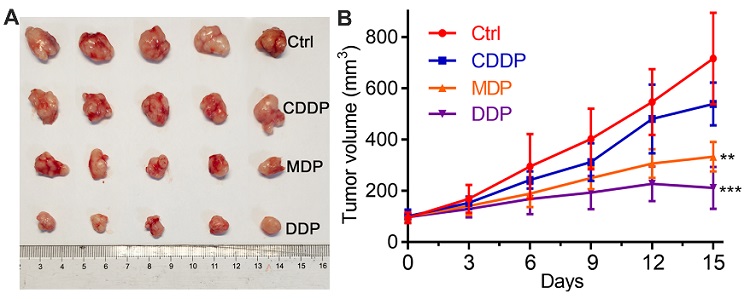
图2. DDP(1.5 mg Pt/kg)对Balb/c小鼠SKOV-3卵巢癌移植肿瘤生长的抑制作用(15天),说明其具有很强的体内抗肿瘤活性。
在SKOV-3肿瘤细胞中,MDP和DDP能同时抑制LDHA和LDHB的表达和活性,降低细胞内乳酸水平,干预细胞糖酵解过程,缓解酸性TME(图3)。
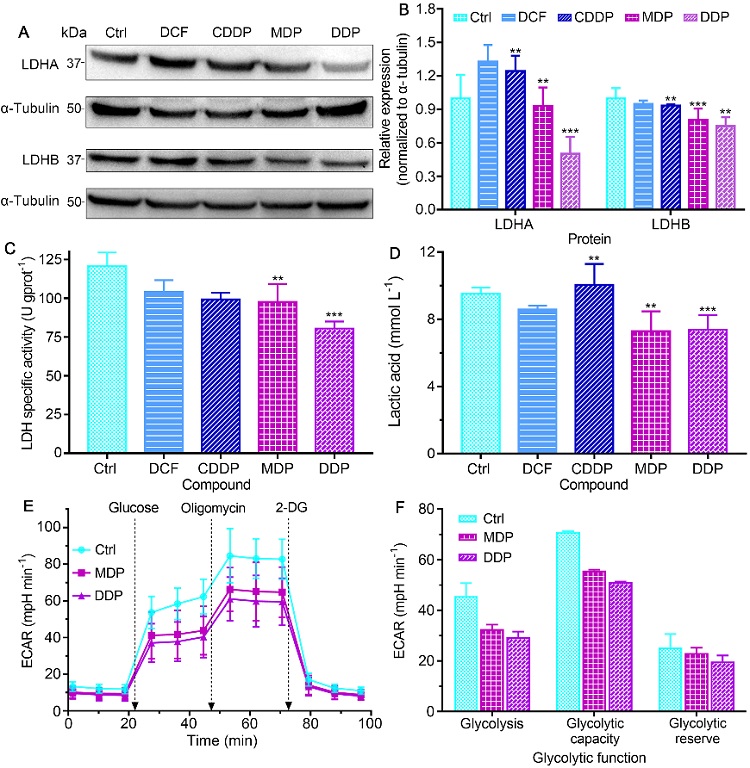
图3. 配合物(0.6 μM)对SKOV-3细胞中LDH表达(A、B,36 h)、活性(C)、乳酸水平(D)、以及糖酵解功能(E、F,18 h)的影响,说明能抑制LDH和乳酸生成,干预能量代谢和TME。
同时,MDP和DDP还能显著抑制MCT1和MCT4的表达,阻止肿瘤细胞乳酸内流或外排,由于乳酸可以促进线粒体氧化磷酸化活性,为肿瘤细胞增殖提供能量,所以阻止乳酸向肿瘤细胞内流可以抑制线粒体氧化磷酸化,从而抑制肿瘤细胞生成ATP(图4)。配合物对Warburg效应和反Warburg效应的双重抑制意味着肿瘤生长的能量供应被彻底切断。
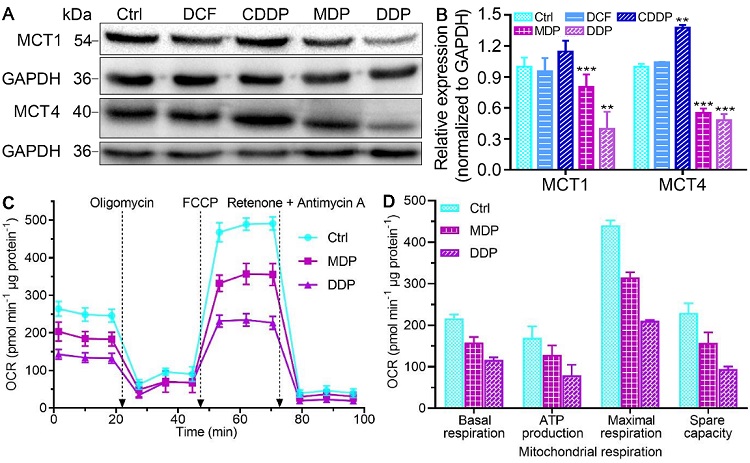
图4. 配合物(0.6 μM)对SKOV-3细胞中单羧酸转运蛋白表达水平(A、B,36 h)及ATP生成(C、D,18 h)的影响,说明可以通过抑制MCT1/4阻止细胞中乳酸内流或外排,进而抑制Warburg效应和反Warburg效应。
巨噬细胞是TME中最丰富的免疫细胞,它可以感知TEM中的乳酸水平变化,触发信号转导进而引起其行为的改变。实验证明,MDP和DDP对肿瘤细胞乳酸生成的抑制作用能够促进巨噬细胞从促肿瘤M2表型向抗肿瘤M1表型极化,并促进分泌干扰素γ(IFN-γ),从而增强巨噬细胞对肿瘤细胞的吞噬和杀伤能力。此外,MDP和DDP可以显著下调HIF-1α和ARG1的表达、降低VEGF含量,具有抑制肿瘤血管生成的能力。
通常认为,铂类药物主要与细胞核DNA发生反应,通过抑制DNA复制和转录诱导细胞凋亡。本研究证明,除了损伤DNA,调节肿瘤细胞能量代谢和TME也是抑制肿瘤的有效途径。根据以上结果,配合物DDP的抗肿瘤机理概括如下:在肿瘤细胞内,DDP抑制LDHA、LDHB、MCT1和MCT4等的表达,从而抑制丙酮酸向乳酸转化并释放到细胞外;在肿瘤细胞外,DDP使TME酸性降低,促进巨噬细胞由M2表型向M1表型极化,肿瘤坏死因子-α(TNF-α)和IFN-γ增加,转化生长因子-β1(TGF-β1)减少;另外,DDP下调HIF-1α和ARG1表达,抑制VEGF分泌,使肿瘤血管生成受到抑制,从而减轻TME对肿瘤免疫的抑制作用(图5)。
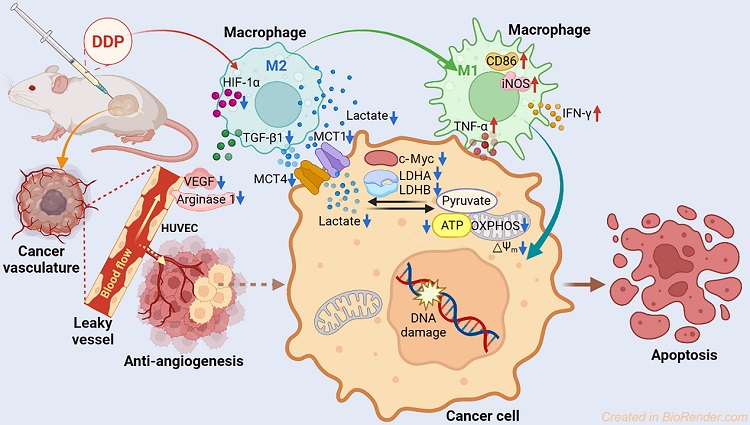
图5. DDP的抗肿瘤作用机理
本论文发表在Chemical Science,第一作者金素星为南京师范大学食品与制药工程学院教师、南京大学生命科学学院博士后;通讯作者王晓勇为南京大学医药生物技术全国重点实验室教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Regulating tumor glycometabolism and the immune microenvironment by inhibiting lactate dehydrogenase with platinum(iv) complexes
Suxing Jin, Enmao Yin, Chenyao Feng, Yuewen Sun, Tao Yang, Hao Yuan, Zijian Guo, Xiaoyong Wang
Chem. Sci., 2023, 14, 8327–8337. DOI: 10.1039/D3SC01874A
导师介绍
王晓勇
https://www.x-mol.com/groups/Wang_Xiaoyong
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
干预DNA损伤修复机制的抗耐药性四价铂抗癌前药 2020-04-24
-
铂配合物作为TREM2抑制剂重塑免疫抑制性肿瘤微环境 2022-11-05
-
铂配合物抑制肿瘤细胞的新机制——诱发内质网应激介导的线粒体自噬 2022-01-25
-
Synthesis of 1-Hydroxy(and 1-Alkoxy, 1-Acyloxy)-1H-indoles and evaluations of their suppressive activities against tumor growth through inhibiting lactate dehydrogenase AEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-11-30 ,DOI:10.1016/j.ejmech.2024.117104Se-Yun Cheon, Ye Eun Kim, Eun-Sun Yang, Yoo Jin Lim, Chang-Hwan Bae, Jung-Sook Jin, Wonyoung Park, Bo-Sung Kim, Chorong Kim, Hyunsung Cho, Seungtae Kim, Sang Hyup Lee, Ki-Tae Ha
-
Cetirizine platinum(IV) complexes with antihistamine properties inhibit tumor metastasis by suppressing angiogenesis and boosting immunityJournal of Inorganic Biochemistry (IF 3.8) Pub Date : 2024-10-28 ,DOI:10.1016/j.jinorgbio.2024.112766Yan Chen, Shuaiqi Feng, Ming Zhang, Suying Li, Ning Zhang, Jun Han, Zhifang Liu, Meifeng Liu, Qingpeng Wang
-
Ciclopirox platinum(IV) conjugates suppress tumors by promoting mitophagy and provoking immune responsesJournal of Inorganic Biochemistry (IF 3.8) Pub Date : 2024-08-11 ,DOI:10.1016/j.jinorgbio.2024.112696Suying Li, Shuaiqi Feng, Yan Chen, Bin Sun, Ning Zhang, Yanna Zhao, Jun Han, Zhifang Liu, Yan-Qin He, Qingpeng Wang
-
Hollow Cu2MoS4 nanoparticles loaded with immune checkpoint inhibitors reshape the tumor microenvironment to enhance immunotherapy for pancreatic cancerZhipeng Yao, Chenxue Qi, Fan Zhang, Hong Yao, Cheng Wang, Xiaoxiang Cao, Chenhui Zhao, Zhichun Wang, Min Qi, Chengyun Yao, Xiaoming Wang, Hongping Xia


































 京公网安备 11010802027423号
京公网安备 11010802027423号