厦门大学朱志课题组Angew:基于核酸适体的LYTACs实现组织特异性的胞外蛋白和细胞膜蛋白的降解
蛋白质是生命活动的直接执行者,当前研发的药物作用方式多是通过抑制靶标蛋白的活性来达到疾病治疗的目的。然而,这些药物,无论是小分子还是抗体,都必须与靶蛋白的活性位点结合才能发挥作用。由于缺乏可结合的活性位点和合适的化学物质,导致80%的人类蛋白质组无法成药。靶向蛋白降解技术的出现为“不可成药”蛋白药物研发提供了新方向。其主要是利用细胞内天然存在的两大蛋白降解系统,即泛素化-蛋白酶体系统与溶酶体降解途径,来实现对疾病相关蛋白的特异、高效降解,从而达到疾病治疗的效果。溶酶体降解技术(LYTACs)能够参与细胞表面膜蛋白和胞外蛋白的降解。但是目前基于低聚糖和抗体的LYTACs化学合成步骤复杂,此外抗体还存在免疫原性、分子量大等缺点。如何实现合成步骤简单,组织特异性降解靶蛋白,是LYTACs降解靶向蛋白技术亟需解决的问题。
针对上述挑战和问题,厦门大学的朱志教授(点击查看介绍)团队提出了基于核酸适体和寡糖的双功能溶酶体靶向嵌合体(Apt-LYTACs),实现组织特异性的胞外蛋白和细胞膜蛋白的降解。设计的嵌合体主要包括两个部分,一个部分是三聚乙酰半乳糖胺(GalNAc),可与肝脏细胞表面特异性表达的去唾液酸糖蛋白受体(ASGPR)结合。另一个部分是核酸适体序列,可与要降解的靶标蛋白特异性结合。通过简单的DNA固相化学合成,将GalNAc修饰于核酸适体的末端。当两个部分分别和相应的靶标结合之后,可将靶蛋白带入溶酶体中,实现靶蛋白的降解(图1)。
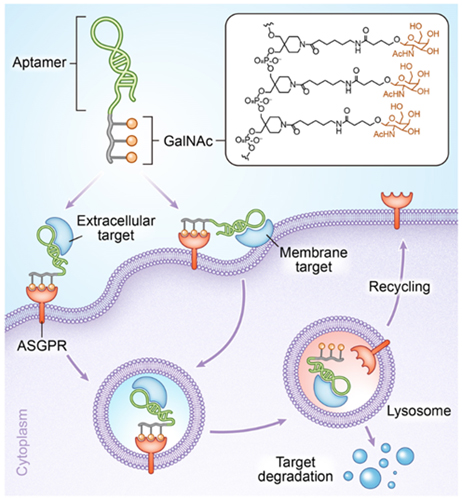
图1. Apt-LYTACs降解胞外蛋白和膜蛋白的示意图。
如图2所示,研究人员合成了含血小板衍生因子(PDGF)核酸适体的嵌合体,通过流式和共聚焦实验,验证了该嵌合体可以实现阳性细胞HepG2对PDGF的组织特异性内吞。通过蛋白印迹(WB)验证了内吞进入细胞的PDGF发生了降解,并且这种降解途径是溶酶体依赖的。随后,合成了含膜蛋白酪蛋白激酶7(PTK7)核酸适体的嵌合体,可实现阳性细胞HepG2上膜蛋白PTK7的降解。而对于只表达PTK7不表达ASGPR的阴性细胞SW480,PTK7表达不受影响。
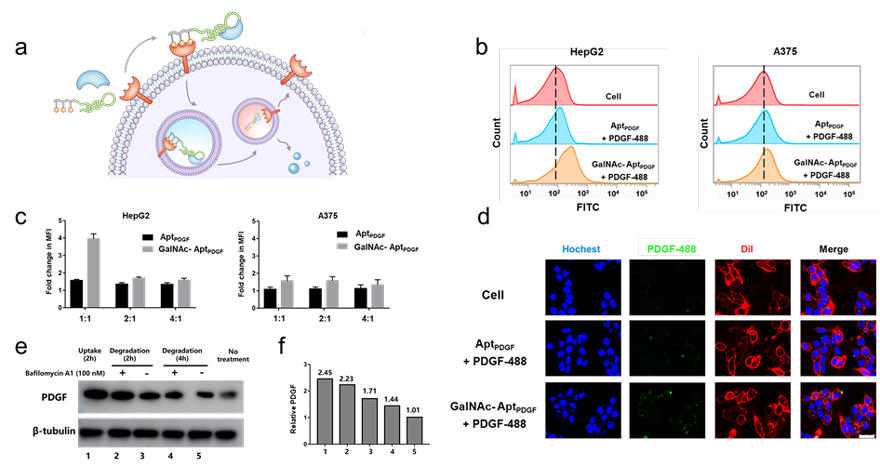
图2. AptPDGF-LYTACs介导PDGF蛋白的细胞特异性内吞和降解。
以上研究初步证明了基于核酸适体和寡糖的双功能溶酶体靶向嵌合体,可实现组织特异性的胞外蛋白和细胞膜蛋白的降解。该嵌合体具有免疫原性低,分子量小,合成简单,寡糖和适体修饰的个数和位点精确可控等优点。该工作为靶向蛋白降解提供了一种新策略。
这一成果近期发表在Angewandte Chemie International Edition上,文章的第一作者是厦门大学化学与化工学院硕士研究生吴昱奇,朱志教授是论文的唯一通讯作者。该工作得到国家重点研发计划和国家自然科学基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Aptamer-LYTACs for Targeted Degradation of Extracellular and Membrane Proteins
Yuqi Wu, Bingqian Lin, Yinzhu Lu, Liang Li, Kunyue Deng, Suhui Zhang, Huiming Zhang, Chaoyong Yang, and Zhi Zhu*
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202218106
导师介绍
朱志
https://www.x-mol.com/university/faculty/14205
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
利用蛋白生物效应器合理设计多功能分子 2022-06-26
-
蛋白质降解技术:药物发现的战略式转变 2021-09-21
-
李敏勇教授课题组JMC:基于HSP90的小分子蛋白降解剂HEMTAC的研究 2023-01-11
-
Recent advances in developing targeted protein degradersEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2024-12-27 ,DOI:10.1016/j.ejmech.2024.117212Binbin Cheng, Hongqiao Li, Xiaopeng Peng, Jianjun Chen, Chuxiao Shao, Zhihua Kong


































 京公网安备 11010802027423号
京公网安备 11010802027423号