中科院深圳先进院房丽晶/陈亮/李红昌团队JACS:基于双功能化合物的新型整合素促进的蛋白质靶向降解IFLD策略
大多数疾病的产生和发展都与特定蛋白的表达或活性异常有关。靶向蛋白质降解技术(TPD)能够特异性地识别靶蛋白,并利用细胞内固有的蛋白质降解途径降解靶蛋白,是调控蛋白水平最直接和有效的方式之一,在克服药物耐药性、降解不可成药靶点等方面具有巨大的优势。近年来,基于泛素-蛋白酶体途径的蛋白水解靶向嵌合体(PROTACs)和最近报道的溶酶体靶向嵌合体(LYTACs)及相关的TPD技术发展迅速,在化学生物学和药物研发领域受到了极大的关注。
细胞外和细胞膜相关蛋白占据了所有基因编码蛋白质的40%左右,其中部分蛋白是导致癌症、衰老、代谢、免疫等多种疾病的关键因素,是一类重要的药物作用靶点。近日,中国科学院深圳先进技术研究院医药所房丽晶研究员、陈亮副研究员以及李红昌研究员团队合作,发展了一种新型整合素促进的溶酶体降解(integrin-facilitated lysosomal degradation, IFLD)策略,使用双功能化合物作为分子降解剂来降解细胞外和细胞膜蛋白。该工作近期在线发表于J. Am. Chem. Soc.期刊上。
整合素(Integrin)是细胞表面表达的细胞粘附受体,在细胞-基质相互作用中发挥重要作用。在整合素家族成员中,αvβ3在多种肿瘤细胞中过表达,因而在肿瘤靶向治疗领域备受关注。在该团队所发展的新型IFLD策略中,将靶蛋白(POI)结合配体与整合素αvβ3识别配体Arg-Gly-Asp(RGD)相偶联,所得到的双功能化合物能够在靶蛋白和整合素之间形成三元复合物,从而诱导细胞外或细胞膜蛋白的内吞,并进入溶酶体中降解。
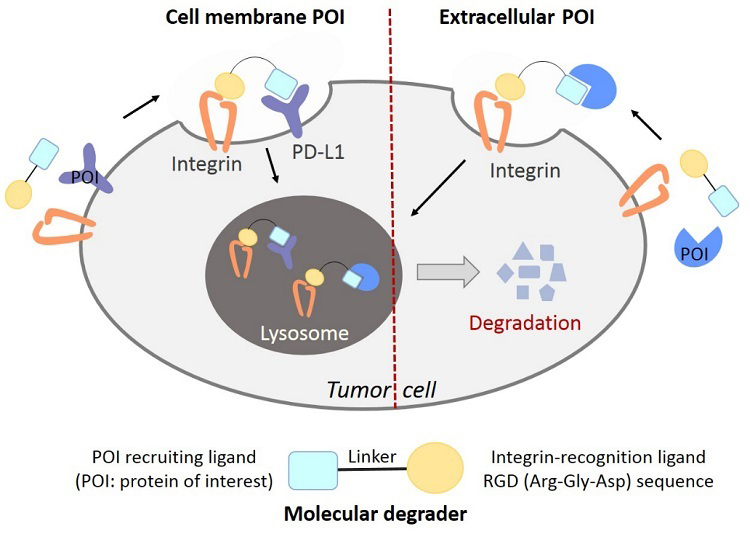
图1. 基于IFLD策略的细胞外或细胞膜蛋白靶向降解技术示意图。图片来源:J. Am. Chem. Soc.
应用IFLD策略,该研究团队首先设计、合成了双功能化合物Biotin-RGD和PH002-RGD,通过细胞实验证实这些化合物均能够通过RGD-Integrin介导的胞吞作用促进胞外蛋白(模式蛋白NAP-650和载脂蛋白ApoE4)的入胞和溶酶体降解。
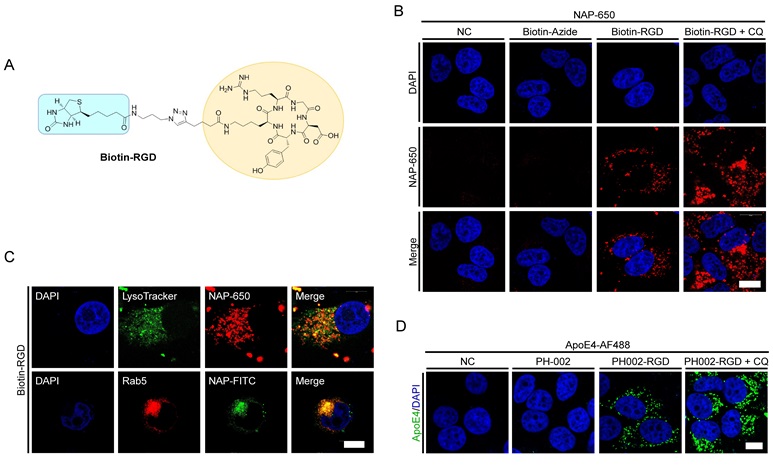
图2. 基于IFLD策略的双功能化合物介导细胞外蛋白的入胞和溶酶体降解。图片来源:J. Am. Chem. Soc.
为了探索IFLD策略对细胞膜蛋白的降解效率,该团队合成了靶向免疫检查点PD-L1的双功能化合物BMS-L1-RGD、BMS-L2-RGD和BMS-L3-RGD,并证实不同的linker长度确实对化合物介导的靶蛋白降解有一定影响,其中BMS-L1-RGD对PD-L1的降解效率最高。进一步的实验结果表明,BMS-L1-RGD能够以整合素和溶酶体依赖的方式诱导细胞膜蛋白PD-L1的降解。

图3. 基于IFLD策略的双功能化合物介导细胞膜蛋白PD-L1的入胞和溶酶体降解。图片来源:J. Am. Chem. Soc.
由于BMS-L1-RGD在细胞水平展现出良好的降解PD-L1的能力,该团队进一步使用B16F10肿瘤异种移植C57BL/6J小鼠模型评估了这种双功能化合物的体内抗肿瘤作用。结果表明,尾静脉注射BMS-L1-RGD能够有效降低肿瘤组织中的PD-L1水平,具有显著的抗肿瘤效果,并且没有明显的毒副作用。
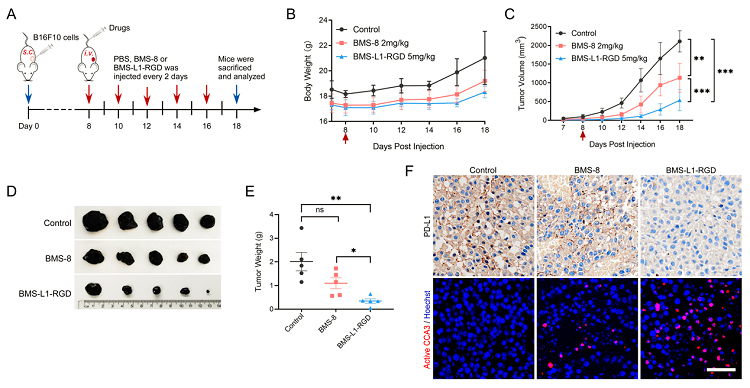
图4. 基于IFLD策略的双功能化合物BMS-L1-RGD的体内抗肿瘤作用。图片来源:J. Am. Chem. Soc.
综上所述,该团队以双功能化合物作为分子降解剂,为细胞外和细胞膜蛋白的靶向降解发展了新型整合素促进的溶酶体降解(IFLD)策略。由于整合素αvβ3通常在肿瘤中过表达,因此该IFLD策略在降解肿瘤相关蛋白方面极具价值。与基于抗体、纳米抗体和核酸适体的降解技术相比,双功能分子作为蛋白质降解剂具有体积小、无免疫原性以及可控的药理学和药代动力学特性等优点。同时,众多蛋白质小分子抑制剂的存在也为IFLD分子降解剂的设计提供了便利。因此,作为一种新型的TPD平台技术,IFLD策略为调节分泌蛋白和膜相关蛋白提供了新思路和新方法,在化学生物学和药物研发领域具有广阔的应用前景。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bifunctional Compounds as Molecular Degraders for Integrin-Facilitated Targeted Protein Degradation
Jiwei Zheng, Wanyi He, Jing Li, Xuejia Feng, Yanyan Li, Binghua Cheng, Yimin Zhou, Meiqing Li, Ke Liu, Ximing Shao, Jianchao Zhang, Hongchang Li*, Liang Chen*, and Lijing Fang*
J. Am. Chem. Soc., 2022, 144, 21831–21836, DOI: 10.1021/jacs.2c08367
导师介绍
李红昌
https://www.x-mol.com/university/faculty/291361
房丽晶课题组
https://www.x-mol.com/groups/Lijing_Fang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号