蛋白质降解技术:药物发现的战略式转变
中国科学院基础医学与肿瘤研究所程向东教授/覃江江研究员团队总结了近几年来蛋白质降解技术的发展、各种技术优缺点以及潜在应用。这一成果近期发表在Journal of Hematology & Oncology 上 (医学1区, TOP期刊,2020年影响因子17.3),文章第一作者为硕士研究生李昊斌和董金云助理研究员,通讯作者为中国科学院基础医学与肿瘤研究所程向东教授和覃江江研究员。
小分子抑制剂 (SMI) 靶向致病蛋白已成为治疗恶性肿瘤的广泛使用的策略。然而,由于缺乏活性位点等原因给 SMI 的设计和开发带来了重大挑战。近年来,蛋白质降解技术的发展为治疗恶性肿瘤提供了可能。从降解途径出发,本论文总结近年来蛋白质降解技术的发展,阐述它们的优缺点以及潜在应用,同时希望能够为降解技术相关药物的设计、发现提供思路。
1 异双功能小分子-蛋白酶体途径
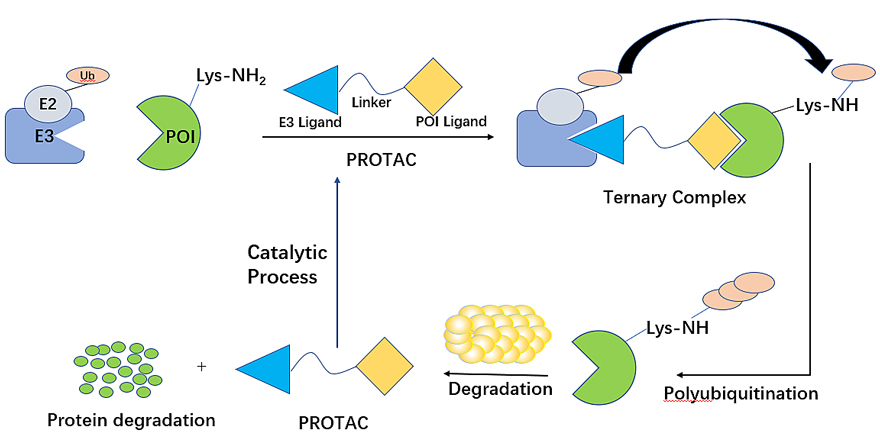
1.1 Proteolysis-targeting chimeric (PROTAC)
蛋白水解靶向嵌合体 (PROTAC) 是一种异双功能分子,由 E3 泛素连接酶的配体、靶蛋白的配体和中间接头组成,通过细胞内泛素-蛋白酶体系统(UPS)介导降解。与传统的SMI 相比,PROTAC剂量更低,并具有更强的持续效应。此外,PROTAC 可以降解“不可成药”的靶标,包括转录因子和支架蛋白。
1.2 Hydrophobic tagging (HyT) technology
疏水标记(HyT)技术依靠含有目标蛋白配体和大疏水基团的化合物来增加目标蛋白表面的疏水性,从而诱导目标蛋白不稳定和错误折叠,从而导致其被蛋白酶体降解。

2 异双功能小分子-溶酶体途径
2.1 Lysosome-targeting chimera (LYTAC)
LYTAC技术通过内体/溶酶体途径降解细胞外蛋白和膜相关蛋白。其分子由特定的 POI 抗体或小分子配体与化学合成的糖肽配体,如 6-磷酸甘露糖(M6P)结合,与阳离子非依赖性 M6P 受体(CI -M6PR)。CI-M6PR 是一种溶酶体转运受体,可以有效地将蛋白质输送到溶酶体进行靶向降解。

2.2 Autophagy-targeting chimera(AUTAC)
AUTAC技术通过自噬途径选择性降解细胞内蛋白质和细胞内碎片,其分子包含降解标签(主要是鸟嘌呤衍生物)和弹头。细胞内容物被隔离在自噬体中,与溶酶体融合,在溶酶体水解酶存在的情况下实现降解。然而,目前的研究缺乏关于 AUTAC 技术机制的关键信息,例如,介导目标自噬货物的泛素修饰类型尚不清楚以及降解标签触发 K63 多泛素化的具体机制尚不清楚等。

3 异双功能小分子-核糖核酸酶途径
3.1 Ribonuclease targeting chimera (RIBOTAC)
包括 microRNA、内含子 RNA 和 lncRNA在内的非编码 RNA (ncRNA),具有广泛的调控基因表达的潜力。这些 RNA 的突变和紊乱与许多疾病有关,因而被认为是潜在的药物靶点。RIBOTAC代表了一种很有前景的 RNA 降解策略,这种嵌合分子类似于 PROTAC 分子的结构,也是通过接头分别连接一个 RNA 结合模块和一个核糖核酸酶 (RNase) 募集模块。与目标 RNA 结合后,RIBOTAC 会募集 RNase 以促进其降解。与基于反义寡核苷酸 (ASOS) 和小干扰 RNA (siRNA) 的传统疗法相比,RIBOTAC 的优势之一是其具有高催化性能,可在低浓度下触发 RNA 降解效应。

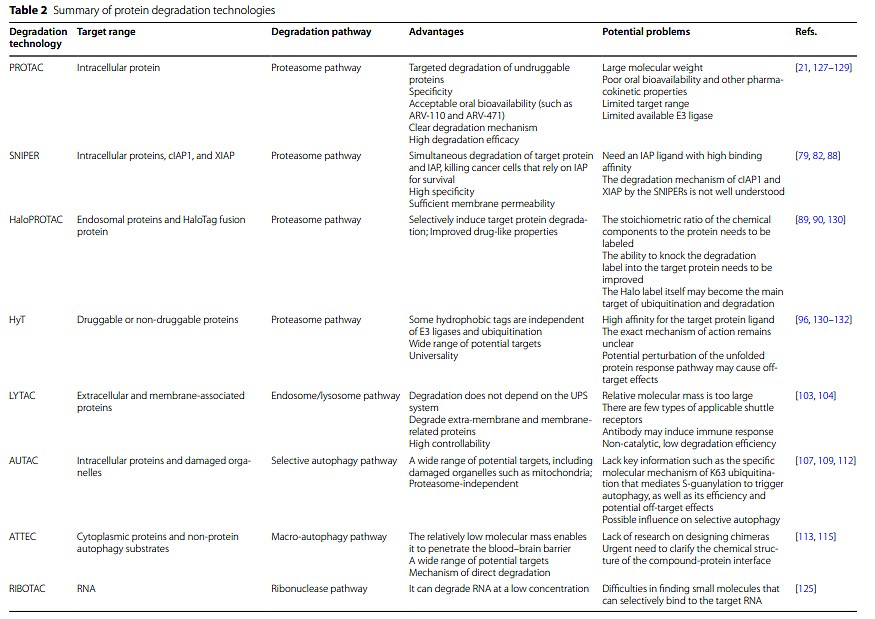
降解技术的发展为相关疾病的治疗提供了许多可行的策略。作者对文中涉及到的降解技术进行了总结:
除了异双功能小分子的降解技术外,一些小分子单体化合物也报道具有降解活性。它们拥有较小的分子量,更容易穿透血脑屏障,而提供了一种降解靶蛋白的新的策略。尽管这些单体降解剂大多是通过经验方法偶然发现的,具有很大的不确定性,但它们理想的药物特性将鼓励研究人员发现更多具有更好治疗效果的单体降解剂。
尽管传统的 SMI 是癌症治疗的重要策略,但它们可能面临许多挑战,例如耐药性。以PROTAC为代表的新型降解技术的出现具有克服SMI的局限性的潜力。许多新兴的降解技术(如LYTAC、AUTAC和 RIBOTAC)也扩大了降解疾病相关靶点的范围,包括不可成药的靶点(如转录因子、支架蛋白和RNA)。虽然它们还处于初始阶段,可能还有一些关键问题需要解决,但它们开辟了未来靶向治疗的主要方向。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Protein degradation technology: a strategic paradigm shift in drug discovery
Haobin Li, Jinyun Dong, Maohua Cai, Zhiyuan Xu, Xiang-Dong Cheng & Jiang-Jiang Qin
J. Hematol. Oncol., 2021, 14, 138, DOI: 10.1186/s13045-021-01146-7
覃江江研究员介绍

覃江江,博士,2011年毕业于上海交通大学药学院,师从张卫东教授。现任中国科学院基础医学与肿瘤研究所研究员,博士生导师,浙江省海外高层次人才,浙江省杰青,致力于消化道恶性肿瘤发生发展分子机制研究及抗肿瘤药物开发。近三年以通讯作者在Drug Resistance Updates、Molecular Cancer、Drug Discovery Today、Journal of Medicinal Chemistry,Journal of Experimental and Clinical Cancer Research, Molecular Therapy-Nucleic Acids, Pharmacological Research, Journal of Natural Products等期刊上发表多篇论文。
课题组长期招聘分子生物学、细胞生物学、肿瘤免疫学、药物化学、药理学等专业博士后,欢迎咨询(jqin@ucas.ac.cn)
https://www.x-mol.com/university/faculty/319239
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
中科院医学所程向东/覃江江团队:小分子靶向信号传导和转录激活因子STAT3的研究进展 2021-07-21
-
靶向降解转录因子的通用策略:TF-PROTACs 2021-07-08
-
“左右互博”:李华教授等提出双重靶向降解(Dual PROTACs)药物设计新概念 2021-05-30
-
《Nature》子刊:利用小分子清除病变蛋白质的新技术 2015-06-15
-
Targeted protein modification as a paradigm shift in drug discoveryEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2023-08-29 ,DOI:10.1016/j.ejmech.2023.115765Roshanak Amirian, Mehdi Azadi Badrbani, Zhila Izadi, Hadi Samadian, Gholamreza Bahrami, Sajad Sarvari, Sara Abdolmaleki, Seyed Mohammad Nabavi, Hossein Derakhshankhah, Mehdi Jaymand
-
Proteolysis targeting chimera (PROTAC) in drug discovery paradigm: Recent progress and future challengesEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2020-10-31 ,DOI:10.1016/j.ejmech.2020.112981Shenxin Zeng, Wenhai Huang, Xiaoliang Zheng, Liyan cheng, Zhimin Zhang, Jian Wang, Zhengrong Shen


































 京公网安备 11010802027423号
京公网安备 11010802027423号