天普大学Ross Wang团队:新型环形肽合成方法,推动多肽药物开发
由于多肽线性结构的不稳定性,其生物学活性被削弱,导致其在药物应用方面受到很多限制。为了解决上述问题,化学家通过设计环形肽的方式,如环肽(cyclic peptide)和订书肽(stapled Peptides)等,提高了α-螺旋肽构象的稳定性,增强了多肽的穿膜能力,从而提升它对靶蛋白的亲和能力。
近年来,已有多种缩合反应和取代反应被成功应用于肽环化合成过程中,例如酰胺偶联、叠氮化物-炔烃环加成、SNAr等取代反应。此外,传统的金属催化也被认为是一种有效方法,如和烯烃环化复分解(RCM)反应。但是,很多已报道的方法不仅需要额外的催化剂如金属络合物或光引发剂,还取决于与多肽上天然氨基酸残基如半胱氨酸的反应。半胱氨酸等通常在蛋白质 - 蛋白质分子间相互作用中起重要角色,并且可能也对蛋白质的的结构折叠和功能起到重要的稳定作用。更重要的是,大多数环形肽包括订书肽的细胞通透性仍然有限。所以开发渗透性好的环化肽仍然具有挑战性,需要在正电荷、疏水性、α-螺旋性和钉合位置等方面达到一个微妙的平衡。
天普大学Rongsheng (Ross) Wang 团队最新利用氟的弱离去能力建立了一种基于氟-硫醇置换反应 (FTDR) 构建环形肽的方法(图1)。具有生物正交性的氟代乙酰胺官能团可以耐受普通化学合成反应的条件,得以被轻易的引入到固相合成的氨基酸构建基块,进而引入到最终的多肽产物里。在体系内加入大量硫醇后,氟代乙酰基团可以在比较温和的条件下被硫醇选择性进行置换反应(图1a)。在此基础上,只需要在多肽的两个位点处引入侧链为氟代乙酰胺的非天然氨基酸(XL或者XD; L或者D代表手型),并以苯二甲硫醇作为接头,就可构建出高效率的订书肽或者环肽(图1b)。
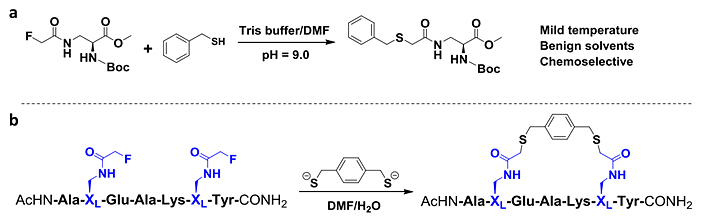
图1 氟-硫醇置换反应 (FTDR)。(a) 苄-硫醇与含 α-氟乙酰胺的氨基酸结构之间的反应; (b) 在未受保护的模型肽和接头 1,4-苯二甲硫醇之间基于 FTDR进行环化 (pH = 9.0–9.5)。蓝色突出显示为含有氨基酸 XL 的 α-氟乙酰胺。
利用细胞穿膜实验,Rongsheng (Ross) Wang 团队发现本方法所构建的Axin订书肽类似物65和67与经典RCM方法合成的碳氢化合物订书肽68相比,表现出更高的穿膜效率(3-9倍)(图2)。同样的,在HIV-1病毒衣壳CAI蛋白的穿膜实验中,基于此方法设计的订书肽具有明显更高效的穿膜能力。
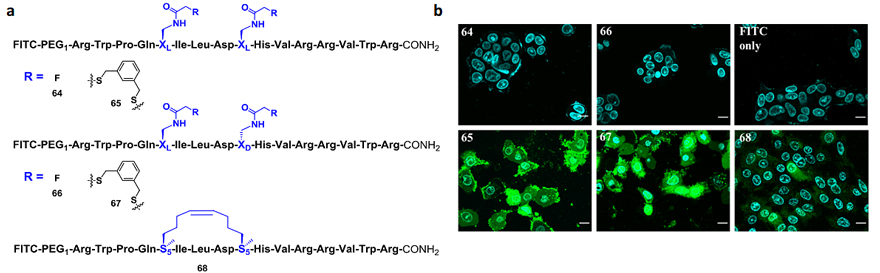
图2. Axin多肽细胞穿膜实验。(a) Axin多肽64-68的化学结构。多肽64、65引入XL和XL;多肽66、67引入XL和XD;多肽64、66未与苯二甲硫醇接头反应; (b) Axin多肽64-68穿透DLD-1细胞的荧光共聚焦照片。FITC组为阴性对照。
为了进一步解析订书肽更加容易的被细胞摄取的原因,Rongsheng (Ross) Wang 团队使用一系列阻断剂处理细胞,如制霉菌素Nystatin (用于阻断小窝蛋白介导的内吞作用) ,氯丙嗪chlorpromazine (用于阻断网格蛋白依赖性内吞作用) ,细胞松弛素 D Cytochalasin D (用于抑制肌动蛋白的聚合作用) 和NaClO3 (用于干扰蛋白聚糖的合成), 随后检测每个处理组的细胞对Axin订书肽类似物65和67的摄取能力,结果表明了采用 FTDR方法的订书肽可能以不同的模式涉及多个内吞途径(图3)。
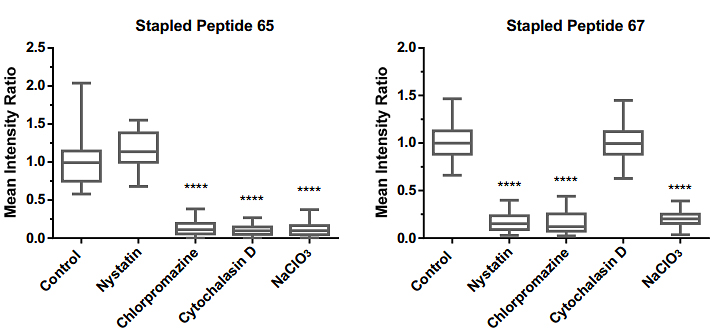
图3. 在用内吞途径阻断剂处理细胞后,对Axin订书肽 65 或 67 的细胞渗透进行定量分析. ****代表p < 0.0001
经过FTDR方法构建的订书肽,因为其对多肽折叠的促进作用和穿膜能力的提升,生物学活性显著增强。FTDR 构建的订书肽 Axin类似物 65和67对β-Catenin的亲和性(图4e)和在血清中的稳定能力(图4 f)都远强于未经改造的原形肽 64。其对癌细胞的抑制作用则显著强于对照组RCM订书肽68和未经改造的原形肽64(图4g和h)。此外,FTDR 构建的其它订书肽,比如P53类似物,也得了类似的更强的癌细胞穿膜能力和生长抑制结果。
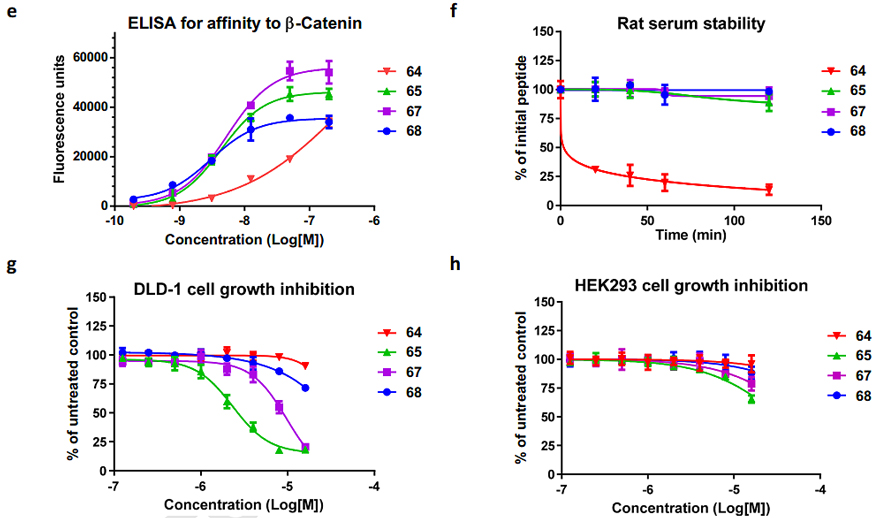
图4. Axin订书肽抑癌能力测试。(e) 与β-Catenin结合亲和力测试; (f) 多肽在100%大鼠血清中稳定性测试; (g) 直肠癌细胞DLD-1生长抑制试验(以h HEK293细胞为阴性对照)
综上所述,Rongsheng (Ross) Wang 团队研发了一种简单温和且高效的构建环形肽的方法。不论是构建i, i + 4 或 i, i + 7 位置的订书肽,还是构建N和C端相连的环肽,都能很好地形成α螺旋并保留其生物学特性。这种方法对肽段内的半胱氨酸结构和功能没有影响, 并赋予多肽比较新颖的细胞穿膜机制和显著增强的细胞吸收效果。这将为环形肽在药物上的应用提供更广阔的舞台。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Unprotected peptide macrocyclization and stapling via a fluorine-thiol displacement reaction
Md Shafiqul Islam, Samuel L. Junod, Si Zhang, Zakey Yusuf Buuh, Yifu Guan, Mi Zhao, Kishan H. Kaneria, Parmila Kafley, Carson Cohen, Robert Maloney, Zhigang Lyu, Vincent A. Voelz, Weidong Yang & Rongsheng E. Wang
Nat. Commun., 2022, 13, 350, DOI: 10.1038/s41467-022-27995-5
Rongsheng (Ross) Wang博士简介
Ross Wang,
2005年取得南京大学化学学士学位。
2010年取得华盛顿大学化学博士学位。
2010 年至2012年就职于圣路易斯生物技术创新公司。
2012年至2016年在美国Scripps研究所进行博士后研究,合作导师Peter G. Schultz。
2016年起,就职于Temple大学化学系。
在相关领域发表SCI论文30余篇,包括以通讯作者发表的Nat. Commun., JACS, ACS Chem. Bio., Mol. Pharm., J. Med. Chem.等,总计被引1300余次。获授权发明专利7项,参与撰写英文书籍1本。美国研究基金会Scialog 研究奖,科特雷尔学者奖(Cottrell Scholar Award),美国国立卫生研究院研究奖 (NIH Maximizing Investigators’ Research Award) 和(美国)国家自然科学杰出青年基金奖(NSF Career Award)获得者。
实验室简介
Rongsheng (Ross) Wang实验室的长期目标是结合有机合成、生物化学、蛋白质工程和分子成像等化学和生物方法,以了解、检测和治疗人类疾病。在化学领域,我们着眼于基础方法学研究,在此基础上发明新的化学反应,用α-氟替代物来取代酰胺或酮基。在生物分析和生物医学领域,我们在研发的生物正交反应的基础上,进一步研发在哺乳动物细胞信号传导中起关键作用的蛋白质-蛋白质相互作用的探针、诊断和治疗试剂。实验室网站:https://rosswang.weebly.com/
现有的研究领域:
蛋白质翻译后修饰(PTM)相关的分子探针研发;
在神经再生中起重要作用的蛋白酪氨酸磷酸酶相关的分子探针的研发;
基于药物化学的小分子和环肽开发。
实验室长期招聘生物学/生物化学/化学方面等领域的博士后和博士研究生。对于进入本组的博士研究生,将接受有机、生物、药物和分析化学方面的广泛培训。欢迎有意向者联系Dr. Ross Wang(rosswang@temple.edu)。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
C-H键活化做“针线活”——肽连接及环肽合成 2021-04-01
-
邻苯二甲醛(OPA)导向的天然未保护多肽的化学选择性环肽方法 2019-09-17
-
南开大学团队Nature Chem.:钯催化的分子内C(sp3)-H键芳基化反应合成环肽 2018-05-15
-
Unprotected peptide macrocyclization and stapling via a fluorine-thiol displacement reactionMd Shafiqul Islam, Samuel L. Junod, Si Zhang, Zakey Yusuf Buuh, Yifu Guan, Mi Zhao, Kishan H. Kaneria, Parmila Kafley, Carson Cohen, Robert Maloney, Zhigang Lyu, Vincent A. Voelz, Weidong Yang, Rongsheng E. Wang
-
Flexible fluorine-thiol displacement stapled peptides with enhanced membrane penetration for the estrogen receptor/coactivator interactionRobert Maloney, Samuel L. Junod, Kyla M. Hagen, Todd Lewis, Changfeng Cheng, Femil J. Shajan, Mi Zhao, Terry W. Moore, Thu H. Truong, Weidong Yang, Rongsheng E. Wang


































 京公网安备 11010802027423号
京公网安备 11010802027423号