上海有机所再发Nature:“精确打击”—烯丙位C-H键选择性官能团化
读者朋友们可能还记得,前不久我们刚刚推送过中科院上海有机所董佳家、K. B. Sharpless团队发表在Nature 杂志的工作——源于“意外”的点击化学新突破,他们不仅发现了点击化学“家族”的新成员,而且解决了当前CuAAC反应所面临的叠氮试剂问题(Nature, 2019, 574, 86,点击阅读详细)。近日,中科院上海有机所再收获一篇Nature,金属有机化学国家重点实验室的刘国生研究员课题组发展了一种复杂烯烃的烯丙位碳氢键(C-H键)高位点选择性、高对映选择性氰化反应,他们与香港科技大学林振阳教授课题组合作,结合实验和理论计算揭示了金属-自由基配位结合调控自由基选择性攫氢的新机制。刘国生课题组博士生李家园是论文的第一作者,上海有机所为第一单位。[1]

刘国生研究员(后排右六)课题组。图片来源:The Liu Group @ SIOC [2]
在反应中,化学家始终需要关注两个重要问题:反应性和选择性。在C-H键官能团化中,实现位点选择性氢原子转移(HAT)通常依赖于底物控制,底物上具有不同键解离能、极性、空间位阻或电性的C-H键决定了位点选择性。不过,有机分子中通常包含多个具有类似性质的sp3 C-H键,与能够促进HAT的试剂(图1a)表现出不可区分的反应性,这给选择性C-H键官能团化带来了巨大的挑战。如果能够增加不同C-H键之间的内在反应性差异,就有可能使HAT具有更好的位点选择性。基于这种思路和大量工作,刘国生研究员课题组发现Cu(II)可以与含有磺酰胺结构和双齿配体的N-中心自由基(NCR)结合(图1b),作为一种可调HAT试剂在含相似烯丙位C-H键的复杂分子中提高位点选择性(图1c);后续手性Cu(II)-氰化物物种对烯丙基自由基的区域、立体和对映选择性捕获,实现高选择性的烯丙位C-H键氰化。考虑到烯烃是构成精细化学品、天然产物、药物分子和有机材料骨架的一类重要的官能团,这种策略无疑为相关领域研究者提供了一种强大的工具,从易得的烯烃出发来制备高价值光学纯化合物;特别是这种策略还适用于含烯烃结构的生物活性分子(包括天然产物和药物)的后期官能团化修饰,为有效构建药物候选库提供一种简洁的方法。
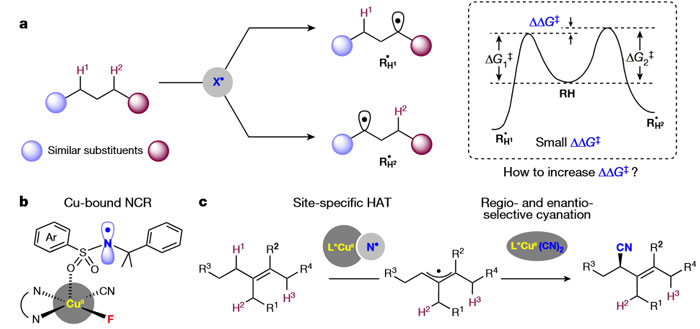
图1. sp3C-H键位点和立体选择性氧化。图片来源:Nature
刘国生研究员课题组先前已经报道过铜催化自由基接力反应,实现了苯乙烯和苄位的C-H键不对称氰化(J. Am. Chem. Soc., 2016, 138, 15547; Science, 2016, 353, 1014,点击阅读详细)。手性Cu(II)-氰化物物种选择性地捕获苄基自由基是构建具有优异ee 值C-CN键的关键步骤。令人欣喜的是,手性Cu(II)氰化物物种也可以区域选择性和对映选择性地捕获烯丙基自由基,得到烯丙位氰化产物。
首先,作者对含有两组烯丙位氢原子的三取代烯烃1a进行了烯丙位氰化反应,考察可能的位点选择性HAT(图2a)。N-氟烷基磺酰胺(NFAS)2a具有中等的位点选择性(C3:C7 = 5:1),以13%的产率得到3a,其中NFAS是结构多样性NCR的前体。在氮原子上引入大位阻的烷基,大大提高了反应的位点选择性和产率(2d,产率67%,C3:C7 = 17:1)。通过引入含有吸电子基团的芳基(2e,C3:C7 = 22:1),进一步提高了位点选择性。令人高兴的是,所有的反应都能够以较好的ee 值得到立体异构体3a,表明手性Cu(II)氰化物以高区域选择性和对映选择性的方式捕获了烯丙基自由基。不同NCR前体2a-2e具有相似的ee 值,证实Cu物种的对映选择性自由基捕获过程与氢原子的攫取步骤无关。
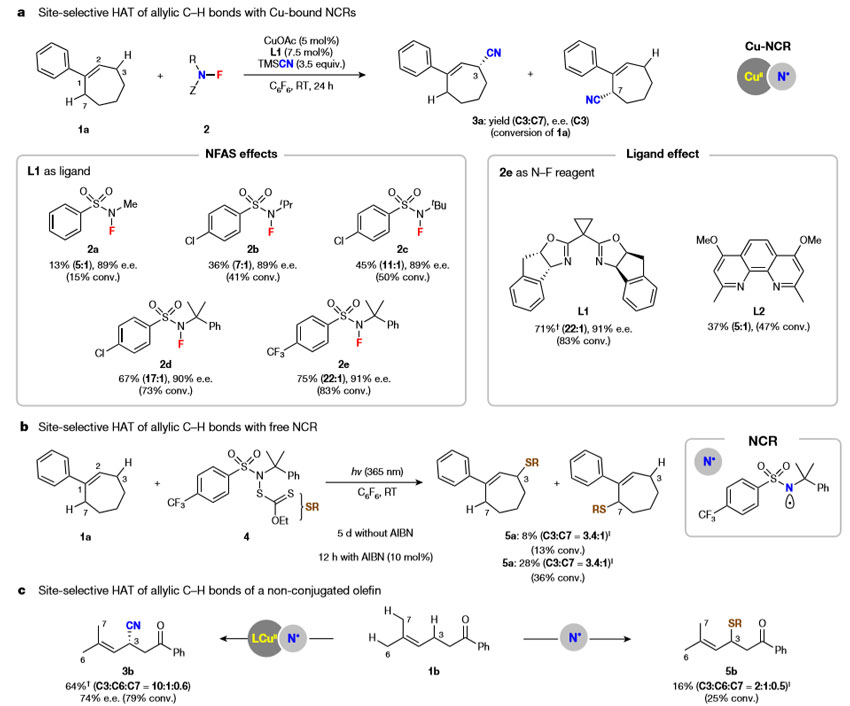
图2. 烯烃的对映选择性烯丙位氰化。图片来源:Nature
更重要的是,配体对位点选择性有显著的影响,配体L2的位点选择性比L1低,位点选择性(3a;C3:C7)从22:1(L1)显著下降到5:1(L2)(图2a)。NFAS和配体对位点选择性(C3:C7)的影响表明HAT过程并不单纯受NCR的控制。2016年Alexanian等人使用亲电试剂N-xanthylamide进行了sp3 C-H键xanthylation(J. Am. Chem. Soc., 2016, 138, 13854),其中酰胺自由基参与了氢原子的攫取。受此启发,作者应用与亲电N-F试剂2e相同磺酰胺结构的类似试剂4,探讨了1a在自由基反应中的位点选择性(图2b)。与Cu催化体系(3a,C3:C7 = 22:1)相比,该反应具有较低的位点选择性(5a,C3:C7 = 3.4:1),表明了用游离NCR作为HAT受体进行位点选择性C-H键官能团化的局限性。非共轭链状烯烃1b的不对称烯丙位氰化反应具有较好的位点选择性,在C3-上选择性地攫取烯丙位氢,以64%的收率和良好的位点选择性(C3:C6:C7 = 10:1:0.6)得到3b(图2c)。相反,自由基链过程对xanthylation产物5b的选择性较差(C3:C6:C7 = 2:1:0.5)。这些结果表明参与烯丙位氰化反应的NCR很可能是与Cu结合的。
作者提出的Cu(II)结合NCR的猜想通过实验得到了证实。首先,用NFAS试剂2f来检测不对称自由基环化的可能性。加入手性配体L3观察到对映选择性诱导的产物6产率为92%,ee 值为15%(图3a)。其次,用电子顺磁共振波谱法监测到N-F试剂2e对(L1)Cu(I)的氧化,得到了Cu(II)信号(图3b(i))。通过添加自由基捕获剂DMPO(7)也探测到了NCR(图3b(ii))。
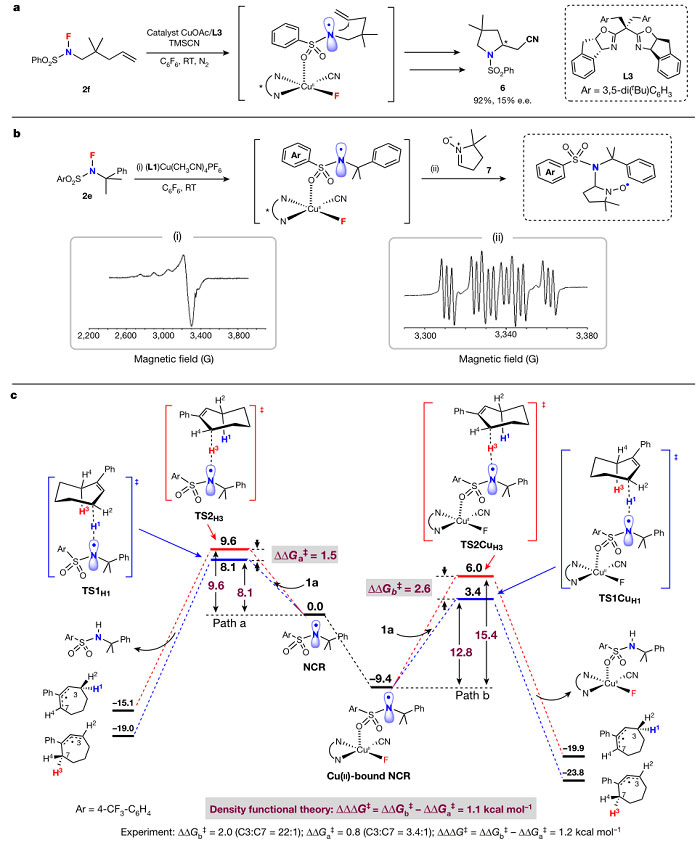
图3. 机理研究。图片来源:Nature
为了进一步探究反应机理,作者在M06理论水平上进行了密度泛函理论(DFT)计算。首先研究了(L1)Cu(I)(CN)与N-F试剂2e的反应,表明该反应易形成Cu(II)结合的NCR物种(图1b和图3c),这种Cu(II)结合的NCR物种比(L1)CuII(CN)F+游离NCR更稳定。作者对其他可能的物种也进行了计算,但都没有Cu(II)结合的NCR稳定。此外,作者计算了Cu(II)结合NCR对1a烯丙位C-H键HAT的活化能垒(路径b),并与游离NCR(路径a)进行了比较。如图3c所示,当NCR与Cu(II)配位时,与HAT相关的能垒分别从8.1 kcal/mol增加到12.8 kcal/mol和从9.6 kcal/mol增加到15.4 kcal/mol。相应的C3和C7位烯丙基HAT的ΔΔG‡ 从1.5 kcal/mol增加到2.6 kcal/mol(即ΔΔΔG‡ = 1.1 kcal/mol),使位点选择性提高了近一个数量级。这一计算结果与1a反应得到的实验结果非常相似(图2b的C3:C7 = 3.4:1,图2a中NFAS试剂2e的C3:C7 = 22:1,ΔΔΔG‡ = 1.2 kcal/mol)。简言之,NCR上的O原子与Cu(II)中心的配位产生了一个反应性自由基,它与C-H键反应的选择性要远好于母体NCR。这种通过金属物种与自由基配位结合来调节自由基的反应性的模式,尚属首次报道。
为了探讨位点和对映选择性烯丙位C-H键氰化反应的底物范围,作者使用了两种NCR前体2d和2e和多种烯烃(图4a(i))。内烯烃包括烯基(杂)芳烃(1c-1e)、烯炔(1f)、烯基硼酸酯(1g)和烯丙基酰亚胺(1h),都能够以较好的收率得到目标产物E-式3c-3h,且反应的区域选择性和对映选择性较好。各种官能团(如邻苯二甲酰亚胺、硅基和硼酸酯)和杂环化合物(如呋喃和吡啶)均可以耐受。特别是,从Wittig反应合成的E-和Z-构型烯烃混合物中可以有效地得到手性烯丙基腈(E-3d和E-3e)。作者还通过3c和10b的克级规模反应验证了该方法在合成中的实用价值(图5b)。
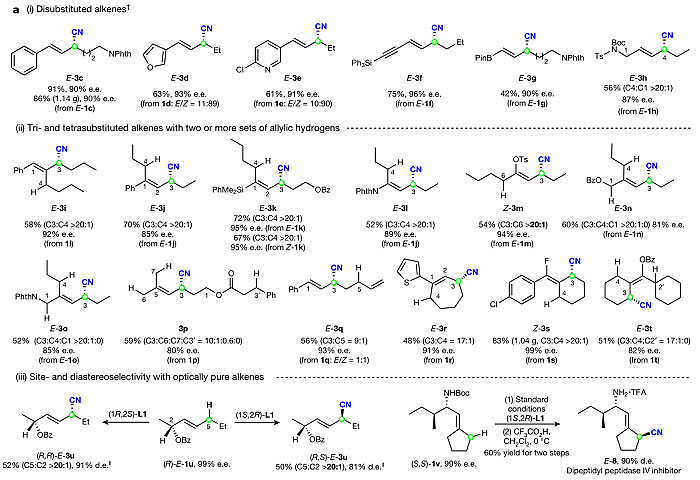
图4. 底物扩展。图片来源:Nature
然后,作者对含有多组烯丙位氢的三取代烯烃类底物进行了考察,它们在反应活性和位点特异性方面都颇具挑战(图4a(ii))。实验结果让人满意,链状三取代烯烃(1i-1m)具有优良的位点选择性。各种官能团如烯基硅烷(E-1k)、烯基酰亚胺(E-1l)和烯基酯(Z-1m)都能够在标准条件下兼容该反应,以较好的位点选择性和对映选择性得到相应的烯丙基腈3k-3m。以烯丙基酯和烯丙基酰亚胺为代表的具有三组烯丙位氢的三烷基取代烯烃(C1、C3和C4)的选择性烯丙位C-H键氰化反应也成功地得到了单一异构体E-3n和E-3o。此外,Cu(II)-NCR对1p也表现出优异的选择性,在烯丙位(键解离能~83 kcal/mol)处有一个亚甲基(C3)和两个甲基(C6、C7),还有一个苄位氢(C3',键解离能~85 kcal/mol),选择性地攫取C3处的烯丙位氢(C3:C6:C7:C3' = 10:1:0.6:0)。此外,非共轭二烯1q(E:Z = 1:1)具有两个类似位阻的烯丙基亚甲基结构,其C3位具有较好的位点选择性(C3:C5 = 9:1)。对于含有环状结构的底物,1r和1s都以较好的位点选择性和对映选择性实现了烯丙位氰化。位阻较大的四取代烯烃1t,也实现了良好的位点选择性和对映选择性以及中等的产率。这些结果表明Cu(II)结合的NCR对HAT的精准位点选择性是由空间环境中非常细微的差异所决定的。
对于光学纯烯丙基酯(R)-E-1u,采用配体L1及其对映体进行立体选择性研究。两者均具有良好的位点选择性和非对映选择性,表明催化剂控制的立体选择性高于底物控制的立体选择性(图4a(iii))。通过烯基(S,S)-1v的高选择性烯丙位C-H键氰化反应,然后脱去NHBoc保护基就可以合成二肽酰肽酶IV抑制剂8。
本文报道的这种自由基接力策略也适用于生物活性分子的高选择性后期官能团化,例如烯丙孕素醋酸酯、炔诺酮醋酸酯、京尼平、布雷非德菌素A和环芬尼等上市药物(图5b)。含有四种不同类型烯丙位氢的烯丙孕素醋酸酯9a的反应表现出显著的高位点、区域和非对映选择性,以65%的收率得到单一异构体10a。含有三种不同类型烯丙位氢和末端炔部分的炔诺酮醋酸酯9b选择性地得到单一异构体10b且末端炔部分完好无损。对于含有二醋酸酯结构的京尼平9c和布雷非德菌素A 9d,具有三组或四组烯丙位氢以及与酯基相邻的可攫取氢,均以优异的位点特异性和非对映选择性得到单一氰化产物10c和10d。将天然产物Phytol转化为醚9e,其中含有三组烯丙位C–H键和三级C–H键。该反应以51%的收率和74%的d.e. 值得到烯丙位氰化产物10e,同时得到5%的甲基(C3)氰化产物。与Rh-卡宾促进C–H键插入和Fe-催化脂肪族C–H键活化不同,该反应未观察到三级C–H键官能团化。此外,相对惰性的四取代烯烃环芬尼9f能以43%的收率和93%的ee 值得到10f。
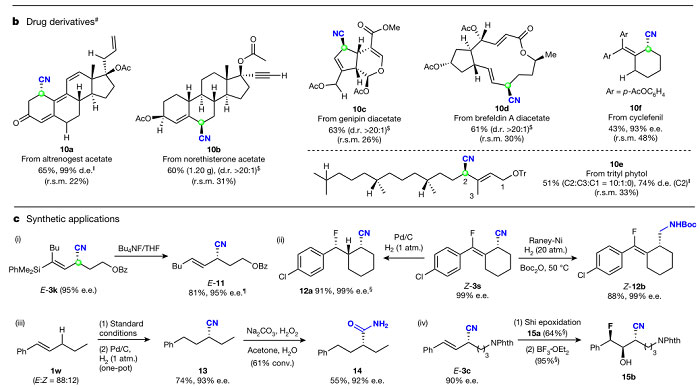
图5. 复杂药物分子的后期修饰及合成应用。图片来源:Nature
光学活性腈在制药工业中具有重要的地位。图4a中的结果表明本文报道的自由基接力法是从简单易得的烯烃合成各种光学活性烯丙基腈的有效方法。此外,所得的手性腈化合物可作为光学活性烷基胺和羧酰胺的结构骨架(图5c(ii)至(iv))。例如,烯丙基腈Z-3s通过选择性氢化有效地转化为烷基腈12a和高烯丙胺衍生物12b且手性保持。值得注意的是,烯烃E/Z混合物1w通过烯丙位C-H键氰化反应随后一锅法的加氢反应得到手性烷基腈13,水解后转化为相应的手性烷基羧酰胺14。此外,烯丙基腈3c经环氧化以良好的非对映选择性得到手性环氧化物15a,接着进行区域选择性开环氢氟化反应,得到高度官能团化的手性腈15b。
总结
刘国生研究员和林振阳教授等研究者发展的铜自由基接力反应,是一种实现复杂烯烃位点选择性和对映选择性官能团化的有效策略。作者用Cu(II)结合的NCR进行位点特异性烯丙位HAT的方法,为进一步探索含有烯丙基和其他类型C-H键的位点特异性和对映选择性C-H键氧化反应奠定了基础。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Site-specific allylic C–H bond functionalization with a copper-bound N-centred radical
Jiayuan Li, Zhihan Zhang, Lianqian Wu, Wen Zhang, Pinhong Chen, Zhenyang Lin, Guosheng Liu
Nature, 2019, 574, 516–521, DOI: 10.1038/s41586-019-1655-8
参考资料:
1. 上海有机所在sp3 C-H键精准转化研究中取得新突破。
上海有机所官网
http://www.sioc.ac.cn/xwzx/tpxw/201910/t20191024_5411978.html
2. The Liu Group @ SIOC
http://guoshengliu.sioc.ac.cn/group/index.html
(注:封面图也来自The Liu Group)
导师介绍:
刘国生
https://www.x-mol.com/university/faculty/15593
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
Science:上海有机所刘国生团队碳氢键官能团化的新突破 2016-09-04
-
有机光氧化还原催化:芳香烃C-H键氰基化 2017-03-21
-
烯烃的催化氧化氰基化反应 2018-07-20
-
上海有机所Nature:源于“意外”的点击化学新突破 2019-10-22
-
Copper catalysed construction of C-P bond: C-H functionalizationJournal of Organometallic Chemistry (IF 2.1) Pub Date : 2025-01-12 ,DOI:10.1016/j.jorganchem.2025.123512Rajnikant N. Ghoghari, Kishor H. Chikhalia


































 京公网安备 11010802027423号
京公网安备 11010802027423号