对Michael-Mannich串联环化反应立体选择性控制机制的洞悉及其从烯胺到乙烯基醚的拓展
现代有机合成非常重视合成效率和实用性,其中复杂结构中立体选择性的精确控制尤为重要,也极具挑战性。顺式和反式四环螺吲哚啉都是大量重要的生物活性吲哚生物碱的核心骨架 (Figure 1),但这些重要结构含有多个立体中心,其精准合成长期受到有效的立体选择性控制方法稀缺的限制。2016年,中科院上海有机化学研究所唐勇研究员与王丽佳副研究员合作,发现了色胺衍生的磺酰烯酰胺与亚甲基丙二酸甲酯的[2+2+2]串联环化反应,实现了具有优异非对映选择性的反式四环螺吲哚的高效合成 (Angew. Chem., Int. Ed. 2016, 55, 9224-9228)。2023年,他们应用该方法以简洁的路线实现了马达加斯加生物碱家族系列四个天然产物的全合成 (CCS Chem. 2023, 5, 124–132)。值得注意的是,如果反应的立体化学能够实现翻转,以获得顺式四环螺吲哚啉,这将更加有价值。因为顺式四环环螺吲哚是更多的吲哚生物碱,例如马钱子碱家族、白坚木碱家族、伊博格碱家族等一系列重要的生物活性天然产物的核心骨架。
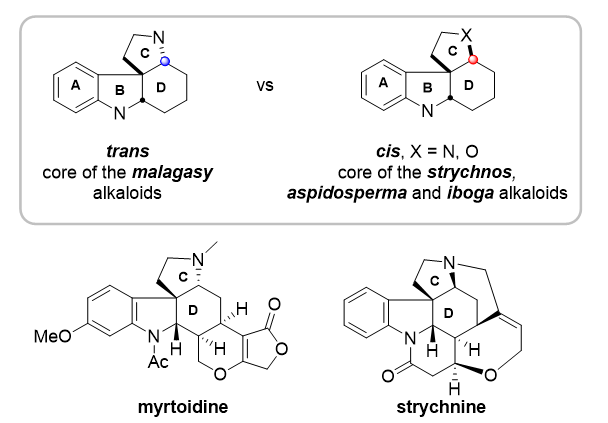
Figure 1. Tetracyclic spiroindoline motifs and representative natural products.
最近,中科院上海有机化学研究所唐勇研究员(点击查看介绍)和华东师范大学王丽佳研究员(点击查看介绍)合作,报道了在串联Michael加成启动的串联Mannich环化中,实现一种简单的立体选择性翻转的研究,用于构建四环螺吲哚啉,提供了以高选择性分别获得单萜吲哚生物碱核心骨架的两个非对映异构体的途径。他们与刘智攀教授合作,通过DFT计算,结合原位NMR实验、对照实验等机理研究,洞悉了该反应经历了独特的逆Mannich/re-Mannich重排历程,包括C(sp3)-C(sp3)键的断裂,这对于饱和六元碳环体系来说是非常罕见的。研究揭示了催化剂的Lewis酸性以及吲哚N-保护基的电子性质主要影响着该反应的立体化学控制。通过对该反应立体选择性控制机制的深入理解,作者预测并实现了将底物从烯胺扩展到乙烯基醚的立体选择性切换。因此,可以随意获得相应的“顺式”和“反式”产物,极大地丰富了不同立体化学的单萜吲哚生物碱的发散性合成的途径 (Figure 2)。
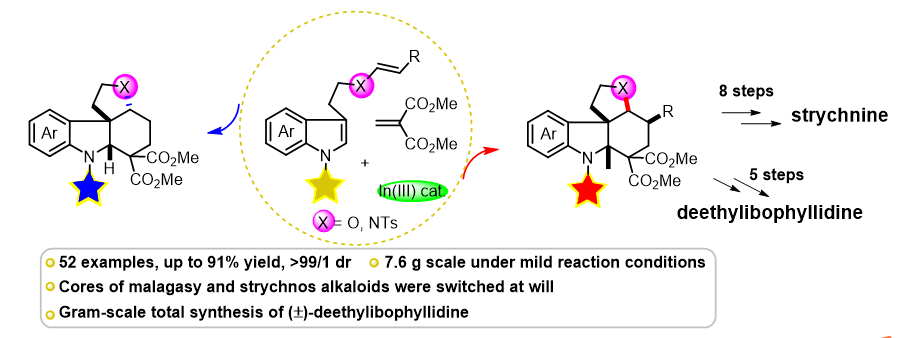
Figure 2. Stereoselectivity Switch in a Michael Addition-Initiated Tandem Mannich Cyclizations and Their Extension from Enamines to Vinyl Ethers
该方法具有反应条件温和、操作简便以及易于放大(>7 g规模)等特点,使其在简洁地合成复杂吲哚生物碱及其类似物方面具有明显优势。文章中,作者采用该方法实现了天然产物马钱子碱的形式合成和deethylibophyllidine的全合成 (Figure 3)。
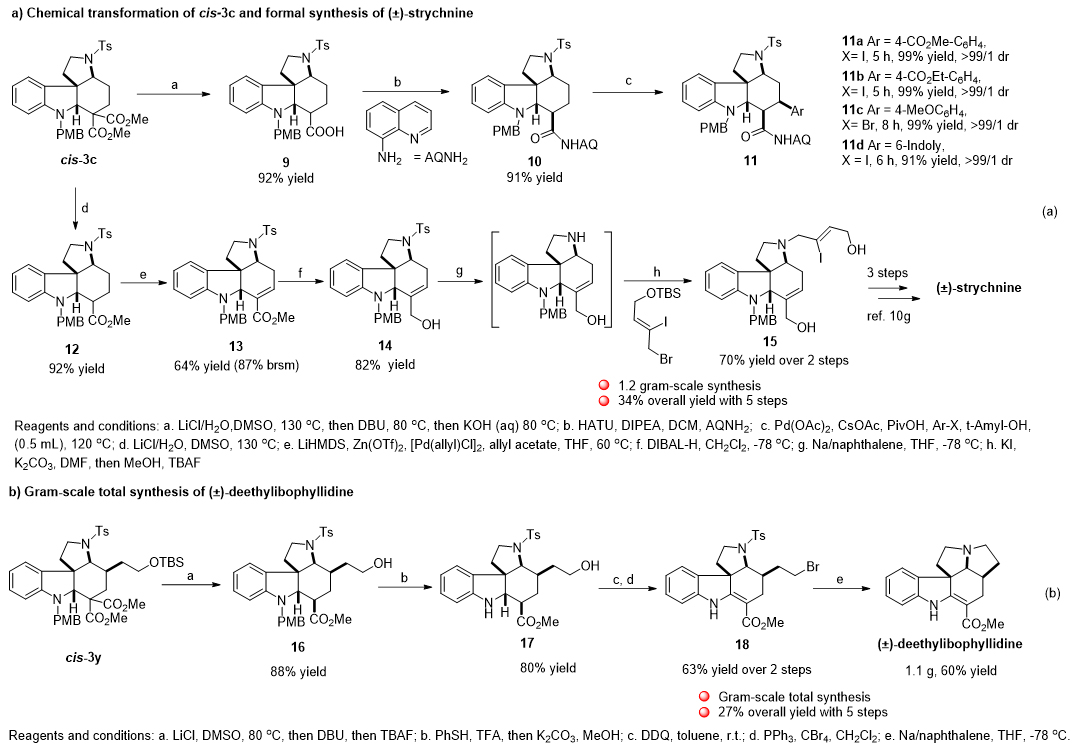
Figure 3. Chemical transformations and gram-scale synthesis of natural products
这一成果近期发表在Journal of the American Chemical Society上,文章的共同第一作者是中科院上海有机化学研究所博士研究生赵留鹏和张圣业。其中赵留鹏贡献了有机合成相关的研究内容,张圣业贡献了DFT计算部分的研究内容。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Insights into Stereoselectivity Switch in a Michael Addition-Initiated Tandem Mannich Cyclizations and Their Extension from Enamines to Vinyl Ethers
Liu-Peng Zhao†, Sheng-Ye Zhang†, Hua-Kui Liu, Yu-Jing Cheng, Zhi-Pan Liu*, Lijia Wang,* and Yong Tang*
J. Am. Chem. Soc. 2023, DOI: 10.1021/jacs.3c04989
导师介绍
唐勇
https://www.x-mol.com/university/faculty/15597
王丽佳
https://www.x-mol.com/university/faculty/15608
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
稳定的亚胺前体-NOAc试剂应用于不对称Mannich反应 2018-03-07
-
不对称催化CP-RA策略构建手性螺缩醛胺和并环缩醛/酮 2020-07-26
-
高效不对称环丁烷化反应及其在Piperarborenine B全合成中的应用 2017-02-20
-
Divergent Strategy for the Synthesis of Indolopyrazines Fused to Benzopyrimidinones and Benzimidazoles: Identification of Antiproliferative MoleculesBilal O. Alkubaisi, Anusha Sebastian, Maximilian Bauer, Shaista Sultan, Raafat El-Awady, Ayeh Wehbe, Mariam Yassin, Srinivasulu Vunnam, Mohammed I. El-Gamal, Taleb H. Al-Tel


































 京公网安备 11010802027423号
京公网安备 11010802027423号