新一代阻断结肠癌恶性转移抑制剂研究的新进展
结肠癌是世界上第三大常见癌症,死亡率高达60%,并且随着经济的快速发展以及人口老龄化的加剧,现今正以4%的年增长率迅速上升,严重威胁了人类健康。结肠癌恶性转移是结肠癌患者高死亡率的主要原因之一。目前的研究表明,APC(Adenomatous Polyposis Coli,腺瘤性息肉蛋白)和Asef(APC-stimulated guanine nucleotide xchange factor,APC刺激的鸟苷酸交换因子)调节细胞的迁移能力,在肿瘤的发生和发展过程中都起着重要的作用。尤其是在APC发生突变的肿瘤细胞中,Asef被持续性地激活,大大增加了肿瘤细胞的迁移能力,从而促进了癌组织的恶性转移。因此,APC-Asef相互作用可作为抗结肠癌恶性转移的新靶标,为缓解和治疗结肠癌提供了新的治疗策略。由于APC-Asef蛋白-蛋白相互作用界面位点宽大且平坦,抑制剂一直未能发现。
上海交通大学医学院张健(点击查看介绍)课题组在2017年的Nature Chemical Biology上报道了首个APC-Asef相互作用抑制剂MAIT-203。该抑制剂可以选择性阻断APC-Asef相互作用,抑制其下游CDC42的GTPase酶活性,从而阻断结肠癌的恶性转移,为结肠癌恶性转移为的治疗开辟新的方向。

图1. APC-Asef新一代抑制剂MAI-400的设计与发现
近日,张健课题组在此研究的基础上,采用一种基于分子内氢键的药物设计的方法,通过APC与多肽抑制剂MAI-150的共结晶结构的分析,识别抑制剂内可以形成分子内氢键的结构基团,设计了一系列能够形成分子内氢键的抑制剂,通过刚性化多肽结构减少熵损失来增强抑制剂对APC-Asef相互作用的阻断作用。利用这一策略,张健课题组成功得到了目前活性最好(Best-in-class)的新一代APC-Asef相互作用抑制剂MAI-400,其IC50高达0.2 µM。为了验证分子内氢键的形成,他们解析了MAI-400与APC的共晶结构,证实了MAI-400中的丝氨酸侧链上的羟基与亮氨酸骨架上的羰基形成了分子内氢键(图1)。进一步的动力学(SPR)实验解释了该分子内氢键的形成增加了MAI-400与APC结合时间并提高活性。此外,热动力学(ITC)实验揭示了该分子内氢键引起的熵变和焓变。
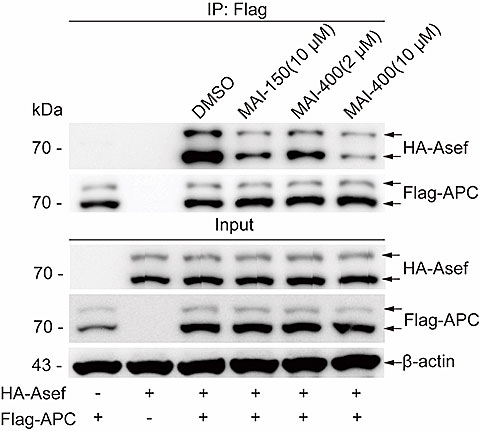
图2. APC/Asef抑制剂MAI-400细胞水平的活性检测
Western Blot实验中观察到,相比前一代抑制剂MAI-150,MAI-400在细胞内能更高效的抑制APC-Asef相互作用(图2)。
该研究得到了目前活性最好的新一代APC-Asef相互作用抑制剂MAI-400,不仅为研究APC-Asef介导的结肠癌恶性转移机制提供了重要工具,也为抗APC-Asef介导的结肠癌恶性转移药物发现提供了优质的先导化合物。此外,张健等提出的分子内氢键药物设计方法为肽类活性分子优化提供了固定构象的新策略,更多的蛋白-蛋白相互作用抑制剂的优化可以受益于这一技术。
这一成果发表在药物化学顶尖期刊Journal of Medicinal Chemistry 上,上海交通大学医学院的张健教授是该论文的通讯作者,上海交通大学医学院的杨秀岩博士为该论文的第一作者,该工作还获得暨南大学丁克教授的帮助和贡献,并得到国家自然科学基金重大研究计划和中组部万人计划基金的支持。
该论文作者为:Xiuyan Yang, Jie Zhong, Qiufen Zhang, Jinxing Qian, Kun Song, Cong Ruan, Jianrong Xu, Ke Ding and Jian Zhang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Rational Design and Structure Validation of a Novel Peptide Inhibitor of the Adenomatous-Polyposis-Coli (APC)–Rho-Guanine-Nucleotide-Exchange-Factor-4 (Asef) Interaction
J. Med. Chem., 2018, 61, 8017, DOI: 10.1021/acs.jmedchem.8b01112
张健教授简介
张健,博士,上海交通大学医学院教授,课题组长,医药生物信息学中心主任,国家自然科学基金优秀青年基金及中组部万人计划青年拔尖人才获得者;主要从事疾病精准靶标识别和First-in-class药物发现,近年来以通讯作者在国际重要学术刊物(如Nat. Chem. Biol.、Chem. Rev.,Chem. Soc. Rev.,Am. J. Hum. Gen.、Nucleic Acids Res.、Bioinformatics、ACS Med. Chem. Lett.等)上发表SCI论文60余篇,他引超过4300次,H因子为35,获国内外专利9项(第一发明人5项);受Springer-Nature出版社邀请作为主编编写Allosteric drug design 一书;担任中国化学会专业委员会委员、中国医师学会精准医学专委会委员、国际药学杂志Acta Pharmaceutica Sinica等编委,Nat. Chem.、Nat. Commun.等40余种SCI期刊审稿人及Austrian Science Fund (FWF)等多项国外基金国际评审人;曾获Roche Creative Chemistry Award、药明康德生命化学研究奖、2017中国十大新锐科技人物,上海市特聘教授东方学者、上海市卫生系统学科带头人和人才最高奖银蛇奖等。
http://www.x-mol.com/university/faculty/49695
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
基于Pazopanib骨架的HDAC/VEGFR多靶点抑制剂的发现 2018-08-20
-
小分子变构调节剂为靶向GPCR药物开发提供新思路 2018-06-22
-
Cell子刊:这真是一个“假”抑制剂 2017-08-03
-
利用捆绑式原位点击化学发现细胞可渗透的O-GlcNAc转移酶抑制剂 2017-06-18
-
Rationally designed peptides inhibit the formation of α-synuclein fibrils and oligomersEuropean Journal of Medicinal Chemistry (IF 6.0) Pub Date : 2025-02-26 ,DOI:10.1016/j.ejmech.2025.117452Tariq T. Ali, Madiha Merghani, Mohammed Al-Azzani, Luisa Maria Gatzemeier, Michael Hoppert, Dora Kaloyanova, Tiago F. Outeiro, Piotr Neumann, Blagovesta Popova, Gerhard H. Braus


































 京公网安备 11010802027423号
京公网安备 11010802027423号