小分子变构调节剂为靶向GPCR药物开发提供新思路
G蛋白偶联受体(GPCRs),由大约1000个基因编码,组成了最大的膜受体家族,每个受体包含保守的七个跨膜(7TM)螺旋,由3个膜外环(ECL1-3)和3个膜内环(ICL1-3)连接。G蛋白偶联受体介导的信号转导是由各种内源性配体触发的,包括神经递质、激素、多肽、趋化因子、脂类、嘌呤等。GPCR信号失调与广泛的人类疾病和疾病有关,如中枢神经系统疾病、癌症、心脏病、代谢和炎症性疾病。因此,G蛋白偶联受体是药物开发的重要靶标。
GPCR家族根据基因序列同源性分为4大亚家族:A类(视紫红质样受体)、B类(分泌素受体家族)、C类(代谢型谷氨酸受体)和F类(the frizzled/taste family)。A类是典型的GPCR超级家族,拥有最大数量的成员。传统的GPCR药物开发聚焦在靶向正位活性位点,是内源性配体的结合位点。在GPCR亚家族的众多成员中,位于胞外或者7TM结构域正位活性位点是高度保守的,阻碍了针对单一GPCR亚型的高度特异性药物的设计。此外,B类GPCR的内源性配体包含肽,由于正位活性位点平而大,小分子不能紧密结合,非肽分子药物的发展具有很大挑战。解决这一挑战的一个可能办法是设计特异的变构调节分子用于特定的GPCR亚型,通过结合它们的变构位点,实现对于GPCR特异性的调节。
上海交通大学医学院的张健(点击查看介绍)课题组最近在药物化学重要期刊Journal of Medicinal Chemistry上详细地阐述并深入分析了GPCR变构药物的规律,并对未来的发展提出前瞻性意见。
他们在文章中指出,通过变构效应对GPCR进行调节以及药物开发具有众多优点。GPCR亚家族的变构位点的序列和结构的多样性提供了特异性变构GPCR调节药物分子发展的基石。而变构调节分子不与内源性配体结合的正位功能位点竞争,只是通过它们在受体上的作用调控内源性正位功能位点的配体作用,不会完全关闭正位功能位点,潜在地减少了副作用的机会。然而,GPCR变构调节分子的开发目前面临着一系列重要挑战,包括变构调节分子SAR(结构-活性关系)的缺乏,变构调节分子的低结合亲和力,将极性和增溶基团(低的log P)整合到变构调节分子的困难,位点出现药物耐受性突变,和物种同系物中变构位点的高度多样性影响模式动物在药效评价中的使用。尽管在GPCR变构调节分子的开发过程中的诸多困难,由于其在选择性和安全性上的巨大优势,近年来仍掀起了GPCR变构调节分子研究热潮,其已发现分子数量成指数增长。
该篇综述对于已经识别变构位点以及变构调节剂的GPCR的晶体结构进行了详尽的总结,如表一:
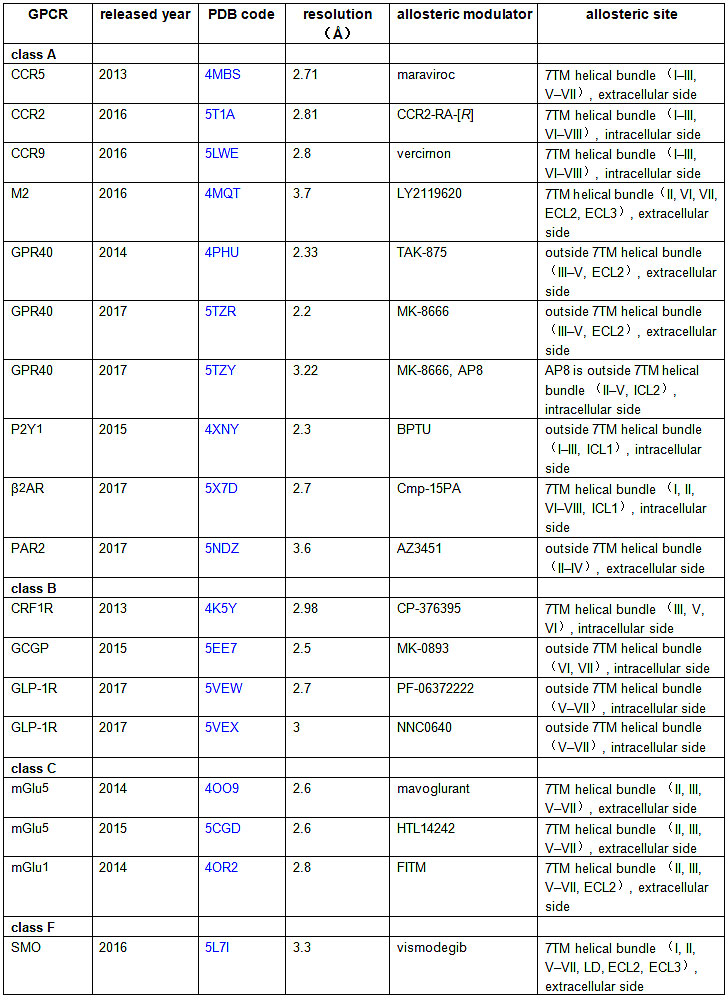
表一 已报道的GPCR与变构效分子的共晶结构。
同时,文章还对于A、B、C、F四类的GPCR已有的变构调节剂的作用模式以及作用机理进行了详细的解析与总结。
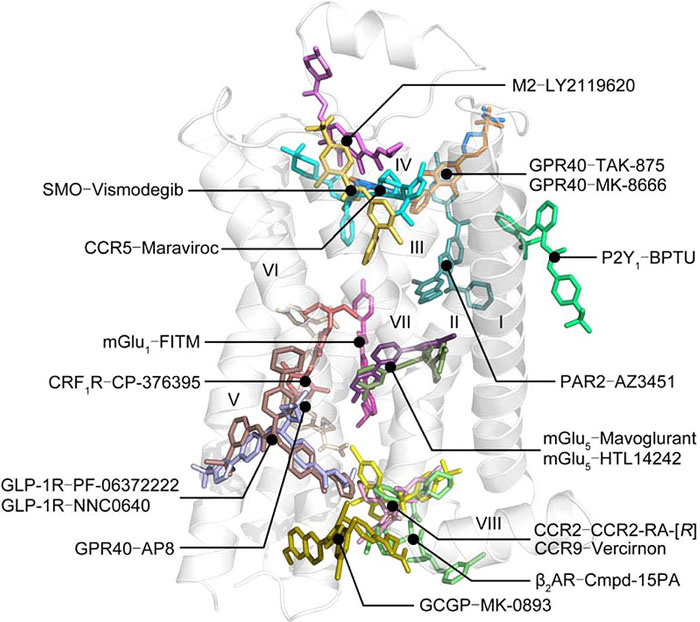
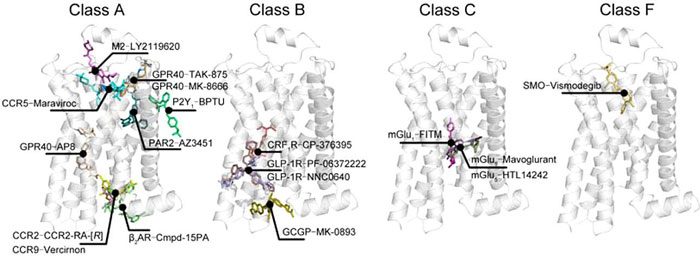
涉及的变构调节剂分子如下图:
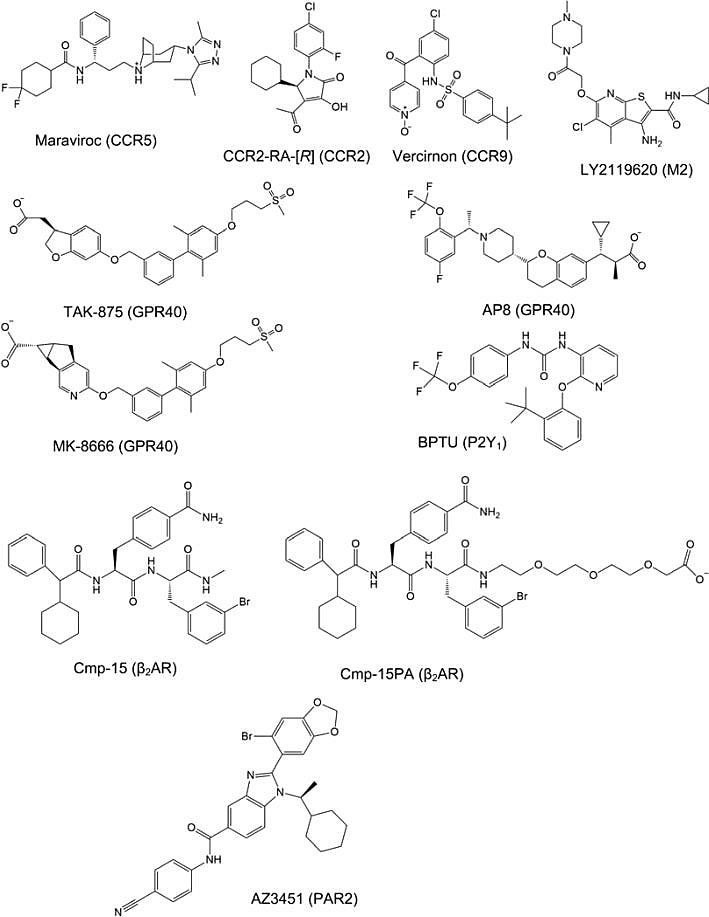
图一 现有报道的作用于A类GPCR的变构调节剂。
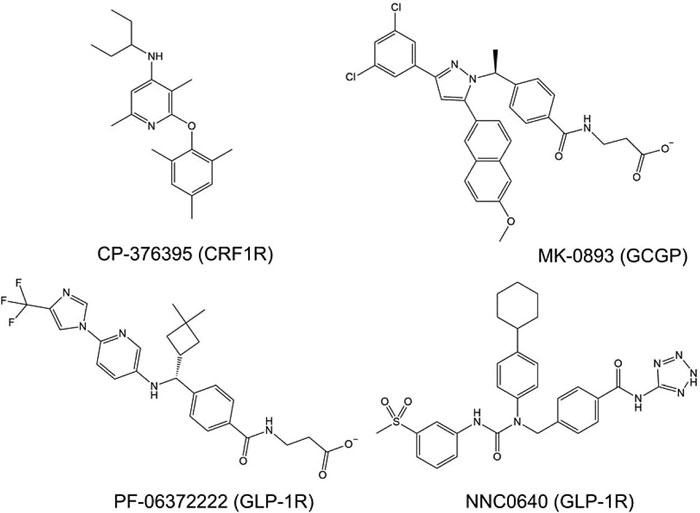
图二 现有报道的作用于B类GPCR的变构调节剂。
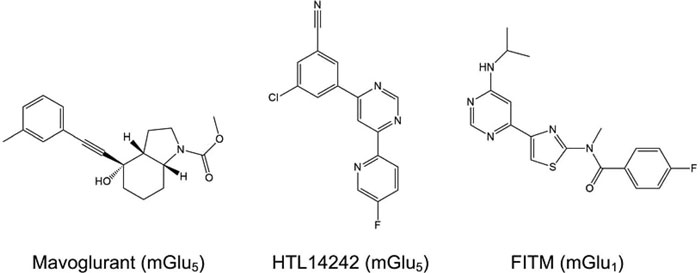
图三 现有报道的的作用于C类GPCR的变构调节剂。
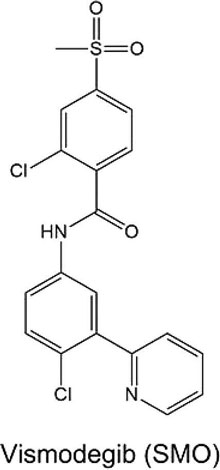
图四 现有报道的作用于F类GPCR的变构调节剂。
虽然目前有关GPCR的变构位点以及变构小分子的晶体结构已经越来越多地被报道,但是相关的结构生物学方面的进展仍然不能够满足目前GPCR药物研发领域的迫切需求。文章作者因此也指出,在未来,除了传统的实验方法之外,计算生物学以及生物信息学的手段也将成为靶向GPCR的变构调节剂开发的一大有力武器,而二者的相互促进与协作,必将推动GPCR药物研发领域的更大的进步。
该文章第一作者是上海交通大学医学院陆绍永副教授,通讯作者为上海交通大学医学院张健教授,相关详细内容和后续工作请访问http://mdl.shsmu.edu.cn 或者关注公众号“分子设计”。
该论文作者为:Shaoyong Lu, Jian Zhang
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Small Molecule Allosteric Modulators of G-Protein-Coupled Receptors: Drug–Target Interactions
J. Med. Chem., 2018, DOI: 10.1021/acs.jmedchem.7b01844
张健教授简介
张健,上海交通大学医学院特聘教授,课题组长,医药生物信息学中心主任,国家自然科学基金委优秀青年基金、中组部万人计划青年拔尖人才及教育部青年长江学者获得者,国家自然科学基金委创新研究群体成员。2002年毕业于北京大学医学部药学院,获理学学位,北京大学优秀毕业生,免试推荐至中国科学院上海药物研究所, 2007年获得药学博士学位,全国优秀博士论文。2009年7月起至今受聘上海交通大学医学院至今。张健教授主要从事药物设计、药物化学、化学生物学和生物信息学研究,特别是变构药物设计方法发展、精准靶标识别和First-in-class药物发现等方向做出了一系列突破性成果。近年来以通讯作者在包括Nat. Chem. Biol., Chem. Rev., Chem. Soc. Rev., Am. J. Hum. Gen., Nucleic Acids Res., Cell. Res., J. Med. Chem., ACS Med. Chem. Lett.等国际学术杂志上发表SCI论文60余篇,他引超过4200次,H因子为35,获国内外专利9项(第一发明人5项)。受邀请将其发展的药物设计方法和标准写入Elseiver出版社经典药物化学丛书“Comprehensive Medicinal Chemistry III”(2017)及Springer出版社的“Methods in Molecular Biology”(2017)丛书。担任中国化学会专业委员会委员,中国医师学会精准医学专委会委员,国际药学杂志Acta Pharmaceutica Sinica等编委,Nat. Chem., Mol. Cell., Nat. Commun.等40余种SCI期刊审稿人及Austrian Science Fund (FWF)等多项国外基金国际评审人。先后主持多项国家自然科学基金、教育部基金、国家重大新药创制等项目,曾获Roche Creative Chemistry Award、药明康德生命化学奖、2017中国十大新锐科技人物,上海市特聘教授东方学者和上海市卫生系统人才最高奖银蛇奖等多项荣誉。
http://www.x-mol.com/university/faculty/49695
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
P2Y1受体激活的分子机理 2016-11-26
-
基于结构的5-HT2B受体新型拮抗剂的开发及在肠易激综合征治疗方面的应用 2016-03-28
-
一文看懂上市药物靶标概况 2017-03-03
-
2-Amino-5-arylethynyl-thiophen-3-yl-(phenyl)methanones as A1 Adenosine Receptor Positive Allosteric ModulatorsPaola Oliva, R. Rama Suresh, Silvia Pasquini, Veronica Salmaso, Edward J. Will, Dilip K. Tosh, Zhan-Guo Gao, Naili Liu, Oksana Gavrilova, Fabrizio Vincenzi, Katia Varani, Kenneth A. Jacobson
-
Stabilization of pre-existing neurotensin receptor conformational states by β-arrestin-1 and the biased allosteric modulator ML314Fabian Bumbak, James B. Bower, Skylar C. Zemmer, Asuka Inoue, Miquel Pons, Juan Carlos Paniagua, Fei Yan, James Ford, Hongwei Wu, Scott A. Robson, Ross A. D. Bathgate, Daniel J. Scott, Paul R. Gooley, Joshua J. Ziarek
-
Allosteric Regulation of G-Protein-Coupled Receptors: From Diversity of Molecular Mechanisms to Multiple Allosteric Sites and Their LigandsInternational Journal of Molecular Sciences (IF 4.9) Pub Date : 2023-03-24 ,DOI:10.3390/ijms24076187Alexander O. Shpakov
-
Discovery of small molecule guanylyl cyclase A receptor positive allosteric modulators [Medical Sciences]Proceedings of the National Academy of Sciences of the United States of America (IF 9.4) Pub Date : 2021-12-28 ,DOI:10.1073/pnas.2109386118S. Jeson Sangaralingham, Kanupriya Whig, Satyamaheshwar Peddibhotla, R. Jason Kirby, Hampton E. Sessions, Patrick R. Maloney, Paul M. Hershberger, Heather Mose-Yates, Becky L. Hood, Stefan Vasile, Shuchong Pan, Ye Zheng, Siobhan Malany, John C. Burnett


































 京公网安备 11010802027423号
京公网安备 11010802027423号