近红外小分子化合物同步实现线粒体靶向成像与多模态治疗
人类的免疫系统通常能够有效维护机体健康,但是当面临严重的健康问题时,往往需要应用复杂的综合疗法来对抗疾病。因此,开发能够同步监测其疗效的多功能靶向治疗药物非常重要。这不但需要药物具有很好的疗效,同时还要求精确地将药物递送到治疗部位,以尽可能避免对身体正常组织造成损伤。线粒体广泛参与细胞代谢、信号传导、分化、生长、凋亡和死亡等重要过程,同时也与创伤和肿瘤等疾患的发生发展密切相关。因此,发现化学小分子靶向线粒体的新机制和研发多功能线粒体靶向小分子受到广泛关注和重视。
第三军医大学史春梦教授课题组近期在Advanced Materials 发表文章提出一种基于化学小分子结构内在的多功能属性研发同步实现线粒体靶向、近红外成像和多模态治疗小分子药物的新策略。针对临床转化的需求,该团队基于目前唯一获得FDA批准的近红外造影剂(ICG)开展结构衍生物研究,通过在ICG 的聚甲炔链中间进行环己烯基取代,同时在其两端的N-烷基侧链末端分别引入亲水性的羧基和亲脂性的酯基,合成ICG的新型类似物IR-DBI。这种不对称的阳离子结构使其能够与白蛋白的二号位点紧密结合,从而在血浆中自组装形成染料-蛋白复合物,首先通过白蛋白介导的EPR效应促进复合物进入肿瘤组织,进一步,IR-DBI小分子在肿瘤微环境中从复合物中释放,通过OATP转运蛋白主动运输机制蓄积于缺氧肿瘤细胞线粒体中。
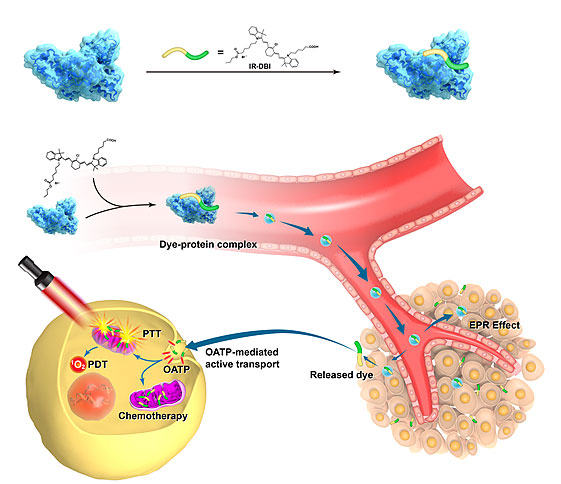
IR-DBI通过白蛋白介导的EPR效应被动运输和转运蛋白介导的主动运输双重机制靶向线粒体示意图
与ICG相比,体内外实验均证实IR-DBI能够选择性地高效蓄积于肿瘤细胞中,对多种肿瘤细胞表现出显著的化学杀伤活性,并在多种皮下荷瘤模型中也能显著抑制肿瘤的在体生长。此外,在近红外激光照射作用下,IR-DBI表现出良好的肿瘤光热和光动力协同疗效。联合光热、光动力及化学治疗显著增强肿瘤治疗疗效,同时大大降低了给药剂量。体内研究显示,联合治疗能够显著地抑制肿瘤的生长,而对正常组织器官无明显影响。在此基础上,通过体外自组装制备人血清白蛋白(HSA)与IR-DBI复合物,也证实与IR-DBI单体相比,肿瘤组织的选择性得到了提高,同时更进一步降低了给药剂量。
上述研究提出了基于结构内在的多功能属性同步实现线粒体靶向、近红外成像和治疗活性的小分子药物研发的新策略,可望为线粒体靶向诊断治疗药物研发提供新的思路。这一成果近期发表在Advanced Materials 上,文章的第一作者是陆军军医大学的谭旭和罗圣霖。
该论文作者为:Xu Tan, Shenglin Luo, Lei Long, Yu Wang, Dechun Wang, Shengtao Fang, Qin Ouyang, Yongping Su, Tianmin Cheng, Chunmeng Shi
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure-Guided Design and Synthesis of a Mitochondria-Targeting Near-Infrared Fluorophore with Multimodal Therapeutic Activities.
Adv. Mater., 2017, 29, 1704196, DOI: 10.1002/adma.201704196
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
线粒体靶向光敏剂在肿瘤光动力治疗中的研究新进展 2016-10-13
-
线粒体定位型高选择性ATP荧光探针的构建 2017-06-17
-
荧光成像研究超氧阴离子和pH对线粒体形态的调控作用 2017-10-05


































 京公网安备 11010802027423号
京公网安备 11010802027423号