基于抗原的快速检测(Rapid diagnostic test,RDT) 是检测是否存在病毒蛋白的方法。抗原RDT可由个人居家完成,操作简便,从采样到得到结果仅需15至30分钟。抗原检测法具备快速且可扩大规模的即时检测性能,但其灵敏度低于大多数基于核酸扩增的检测(Nucleic acid amplification test, NAAT)。抗原检测灵敏度比核酸检测(RT-PCR)低100至1000倍,但一般仍足以发现正在传播病毒的人。
关于应用RDT检测SARS-CoV-2的主要指南和建议汇总表1。
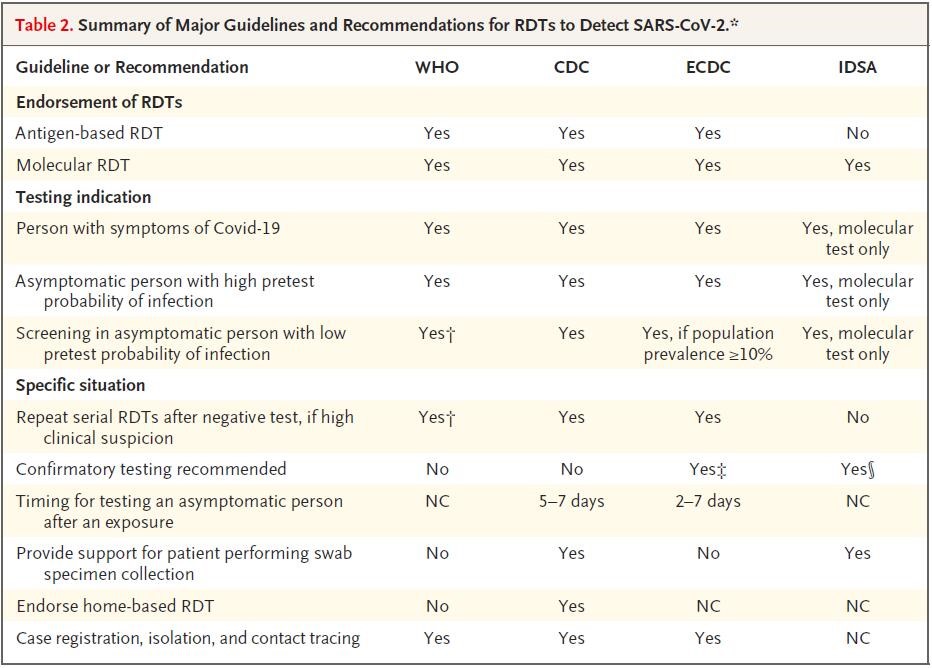
†WHO支持在学校、养老院和医疗机构等人员密集环境发生疑似COVID-19暴发后,将基于抗原的RDT用于系列筛查策略,并强调指出这些检测法在病毒持续传播的环境中最为可靠(他们将持续传播定义为检测阳性率≥5%)。
‡ 欧洲疾病预防和控制中心ECDC建议对所有基于抗原的RDT进行确认,确认方法是实验室核酸检测(NAAT)或另一种基于抗原的RDT。
§美国传染病学会IDSA建议,检测有症状者或筛查无症状者时采用核酸扩增检测法,而不采用基于抗原的RDT。然而,IDSA认为,在分子检测法既不易获得也不可行的地区,采用基于抗原的RDT或有帮助。

Figure 1. Pathophysiology and Timeline of Viremia, Antigenemia, and Immune Response during Acute SARS-CoV-2 Infection1.
Drain等在《新英格兰医学杂志》的综述认为:基于抗原的检测法在症状出现后将保持阳性5~12天,而且在病毒载量高的感染者中性能较高,而病毒载量与疾病严重程度和死亡相关1。因此,与核酸检测相比,抗原检测与复制型SARS-CoV-2之间可能有更高的相关性,并且可能提供有关潜在传染性的信息。研究表明,应用各种基于抗原的RDT筛查无症状者时,可达到不同程度的临床准确度(灵敏度,36%~82%;特异度,大约98~100%)2–4。
Boum等展示了抗原检测与核酸检测用于症状发作后第一周、第二周、第三周的新冠患者、无症状感染者以及密切接触者的结果。与核酸检测相比,基于抗原的快速诊断检测灵敏度在症状出现后的前七天为80.0%(95%CI 71.0–88.0),在症状出现后的第二周为76.0%(59.0–88.0),在第三周下降到19.0%(6.0–38.0),如下表5。


Figure 2: Timelines for optimal use of different diagnostic tests for COVID-19 detection and host response6.
Peeling等发表在《柳叶刀》上的综述认为6: 核酸检测新冠感染的准确度高,可检测到低病毒载量,检测下限为每毫升102-103基因组拷贝;但耗时长、成本相对高,且需要专业人员和工具。而抗原RDT可实现快速检测,操作简单、成本低;但准确度不如分子检测,病毒载量低或是无症状的情况下存在漏检。抗原检测下限为每毫升105-106基因组拷贝,但病毒载量低于每毫升106基因组拷贝的个体不太可能传播病毒,因此抗原RDT可快速识别最有可能传播病毒的感染者7–10。
Peeling等6还分析了新冠感染特征对检测策略的影响: 1. 无症状和症状前人群:无论感染者的临床表现如何(无症状、出现症状之前或有症状),都可以在感染者的鼻部检测到高浓度的病毒。这一特征意味着仅对有症状人群进行检测不足以控制病毒的传播。2. 传染性持续时间:来自17个国家共113项研究的证据表明,新冠病毒核酸最早可在症状出现前6天检测到,在症状出现时或几天后达到峰值,通常发病约2周后从上呼吸道样本中不再能检测到。下呼吸道样本中的病毒载量可能更高、出现峰值较晚,并且持续时间更长。病毒培养研究表明,尽管患者在出现症状后的数周内仍可检出核酸阳性,但症状出现9天后采集的样本中无法再培养出活病毒。这提示传染风险主要集中在症状发作前2~3天到症状发作后8天内。3.病毒变异:需要关注核酸检测的有效性是否受到新冠变异株影响;不过,几乎所有的抗原检测都使用新冠病毒核衣壳蛋白作为靶标,因此受病毒变异影响的可能性较小。
Boum等使用抗原检测的 1082 个样本中有 118 个(11%)出现了假阳性结果5。在201个核酸阴性样本中,Leber 等使用抗原检测出22个(10.9%)假阳性结果;而在826个核酸阳性样本中,抗原检测产生了38个(4.6%)假阴性结果7。
Kohmer等8比较了100例临床样本(74例核酸阳性,26例核酸阴性)4种抗原检测,结果如下表:

The overall Ag-RDT sensitivity for rRT-PCR-positive samples ranged from 24.3% to 50%. However, for samples with a viral load of more than 6 log10 RNA copies/mL (22/100), typically seen in infectious individuals, Ag-RDT positivity was between 81.8% and 100%. Only 51.6% (33/64) of the rRT-PCR-positive samples were infectious in cell culture.
Lanser等评估了抗原检测与Ct值的关系9。51例核酸阳性样本的抗原检测结果如下表所示:
Panbio™ COVID-19 Ag Rapid test (Abbott, Chicago) results stratified by different Ct value cut-offs.

The low number of positive antigen test results in subjects with higher Ct value > 33 which are considered to be not contagious9. https://www.cdc.gov/coronavirus/2019-ncov/hcp/duration-isolation.html
用核酸检测(或第二种抗原检测试剂)对抗原检测初筛的阳性结果进行复核,可减少假阳性。

(B) Testing algorithm for individuals with COVID-19-like symptoms when molecular testing is not available or results are delayed.

(C) Testing algorithm for COVID-19 case finding among asymptomatic individuals.
Bradley A. Connor11等基于纽约市内的员工筛查计划数据进行分析发现,具有任何的新冠病毒疾病(COVID-19)主要症状的个体,都被排除在这次筛查分析之外。快速抗原检测取样自中鼻甲鼻拭子,抗原检测结果如为阳性,那么在第一次检测出结果的1小时需要接受第二次鼻拭子抗原检测。同时,研究团队也对所有鼻拭子样本进行了核酸检测(方法为RT-qPCR)。
最终共有179127人接受了快速抗原测试并被纳入分析,他们的中位年龄为36岁。首次快速抗原检测共有623例(0.35%)阳性结果,其中核酸检测为真阳性的有238例(38%)。
623例首次抗原阳性者中,569人(91%)随后进行了第二次快速抗原检测:
224人第二次抗原检测也为阳性,207人(92%)经核酸检测复核为真阳性。
345人第二次抗原检测为阴性,328人(95%)经核酸检测复核为真阴性。
综合真阳性和真阴性的数据,第二次抗原检测的总体估计准确度(Estimated accuracy)为94%。
Bradley A. Connor指出,以核酸检测结果作为对照,在针对无症状个体的筛查计划中,两次独立但连续的快速抗原检测阳性可以提高阳性结果的准确度。“这对于如何开展快速抗原检测以获得更准确的结果具有重要意义,特别是在获取结果时间紧迫、而广泛开展核酸检测又投入过大的情况下。”论文也客观提到了研究局限性。比如,当社区感染率较高时,抗原检测结果通常更准确,而这项研究针对的人群都没有症状。“但无论单次检测准确度如何,第二次抗原测试的诊断价值仍然很高”。
三者各有优势、局限性和适用场景。随着疫情发展,恰当的联合检测是重要趋势。
核酸检测:用于确诊,并作为启动公共卫生措施的依据。
抗原检测:操作简单、出结果快、成本低。可用于快速筛查高风险个体,促进社会活动复苏。
抗体检测:可回顾监测感染或疫苗接种,为公共政策提供信息。但与个体保护效应的关联有待进一步研究。

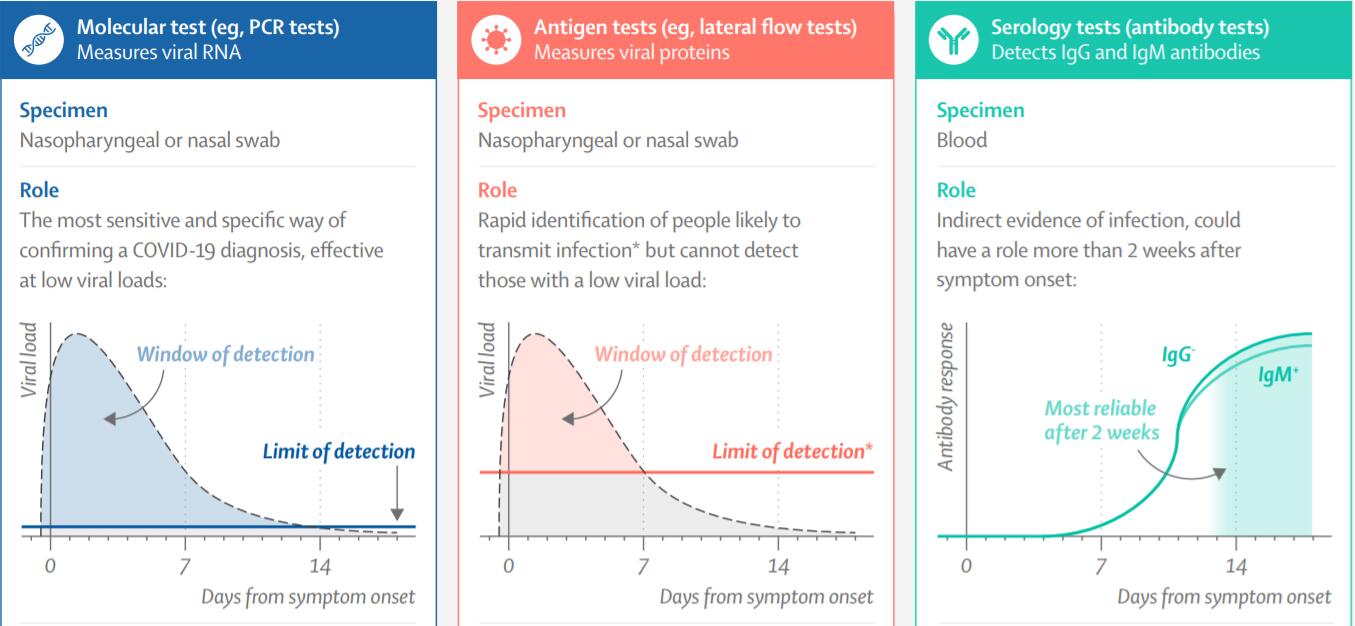
A. 分子检测(如PCR核酸检测):目的是检测病毒基因(RNA),通常采集鼻咽拭子或鼻拭子。诊断新冠感染的准确度高,可检测到低病毒载量,检测下限为每毫升102-103基因组拷贝;但耗时长、成本相对高,且需要专业人员和工具。
B. 抗原检测:目的是检测病毒蛋白(如核衣壳或刺突蛋白),通常采集鼻咽拭子或鼻拭子。可快速检测,操作简单、成本低;但准确度不如分子检测,病毒载量低或是无症状的情况下难以检测。尽管检测下限仅为每毫升105-106基因组拷贝,但病毒载量低于每毫升106基因组拷贝的个体不太可能传播病毒,因此可快速识别最有可能传播病毒的感染者。
C. 血清学(抗体)检测:目的是检测IgG和IgM抗体,通常采集血液样本。出现症状2周后结果比较可靠;可用于回顾分析,但可能有假阳性。
参考文献:
1. Drain, P. K. Rapid Diagnostic Testing for SARS-CoV-2. N Engl J Med 386, 264–272 (2022).
2. Pray, I. W. et al. Performance of an Antigen-Based Test for Asymptomatic and Symptomatic SARS-CoV-2 Testing at Two University Campuses - Wisconsin, September-October 2020. MMWR Morb Mortal Wkly Rep 69, 1642–1647 (2021).
3. Prince-Guerra, J. L. et al. Evaluation of Abbott BinaxNOW Rapid Antigen Test for SARS-CoV-2 Infection at Two Community-Based Testing Sites - Pima County, Arizona, November 3-17, 2020. MMWR Morb Mortal Wkly Rep 70, 100–105 (2021).
4. Drain, P. et al. Performance of the LumiraDx Microfluidic Immunofluorescence Point-of-Care SARS-CoV-2 Antigen Test in Asymptomatic Adults and Children. Am J Clin Pathol aqab173 (2021) doi:10.1093/ajcp/aqab173.
5. Boum, Y. et al. Performance and operational feasibility of antigen and antibody rapid diagnostic tests for COVID-19 in symptomatic and asymptomatic patients in Cameroon: a clinical, prospective, diagnostic accuracy study. Lancet Infect Dis 21, 1089–1096 (2021).
6. Peeling, R. W., Heymann, D. L., Teo, Y.-Y. & Garcia, P. J. Diagnostics for COVID-19: moving from pandemic response to control. The Lancet 399, 757–768 (2022).
7. Leber, W. et al. Comparing the diagnostic accuracy of point-of-care lateral flow antigen testing for SARS-CoV-2 with RT-PCR in primary care (REAP-2). EClinicalMedicine 38, 101011 (2021).
8. Kohmer, N. et al. The Comparative Clinical Performance of Four SARS-CoV-2 Rapid Antigen Tests and Their Correlation to Infectivity In Vitro. J Clin Med 10, 328 (2021).
9. Lanser, L. et al. Evaluating the clinical utility and sensitivity of SARS-CoV-2 antigen testing in relation to RT-PCR Ct values. Infection 1–3 (2020) doi:10.1007/s15010-020-01542-0.
10. Porte, L. et al. Evaluation of a novel antigen-based rapid detection test for the diagnosis of SARS-CoV-2 in respiratory samples. Int J Infect Dis 99, 328–333 (2020).
11. Connor BA, Rogova M, Garcia J, et al., Comparative Effectiveness of Single vs Repeated Rapid SARS-CoV-2 Antigen Testing Among Asymptomatic Individuals in a Workplace Setting. JAMA Netw Open, (2022).