当前位置:
X-MOL 学术
›
Int. J. Oral Sci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
The importance of a potential phosphorylation site in enamelin on enamel formation.
International Journal of Oral Science ( IF 10.8 ) Pub Date : 2017-11-29 , DOI: 10.1038/ijos.2017.41 Wen-Juan Yan , Pan Ma , Ye Tian , Jing-Ya Wang , Chun-Lin Qin , Jian Q Feng , Xiao-Fang Wang
International Journal of Oral Science ( IF 10.8 ) Pub Date : 2017-11-29 , DOI: 10.1038/ijos.2017.41 Wen-Juan Yan , Pan Ma , Ye Tian , Jing-Ya Wang , Chun-Lin Qin , Jian Q Feng , Xiao-Fang Wang
|
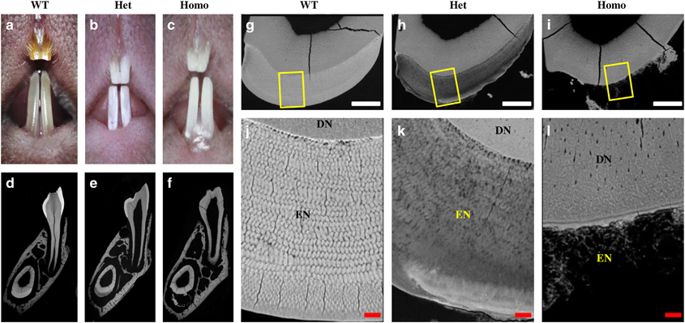
Enamelin (ENAM) has three putative phosphoserines (pSers) phosphorylated by a Golgi-associated secretory pathway kinase (FAM20C) based on their distinctive Ser-x-Glu (S-x-E) motifs. Fam20C-knockout mice show severe enamel defects similar to those in the Enam-knockout mice, implying an important role of the pSers in ENAM. To determine the role of pSer55 in ENAM, we characterized ENAMRgsc514 mice, in which Ser55 cannot be phosphorylated by FAM20C due to an E57>G57 mutation in the S-x-E motif. The enamel microstructure of 4-week-old mice was examined by scanning electron microscopy. The teeth of 6-day-old mice were characterized by histology and immunohistochemistry. The protein lysates of the first lower molars of 4-day-old mice were analyzed by Western immunoblotting using antibodies against ENAM, ameloblastin and amelogenin. ENAMRgsc514 heterozygotes showed a disorganized enamel microstructure, while the homozygotes had no enamel on the dentin surface. The N-terminal fragments of ENAM in the heterozygotes were detained in the ameloblasts and localized in the mineralization front of enamel matrix, while those in the WT mice were secreted out of ameloblasts and distributed evenly in the outer 1/2 of enamel matrix. Surprisingly, the ~15 kDa C-terminal fragments of ameloblastin were not detected in the molar lysates of the homozygotes. These results suggest that the phosphorylation of Ser55 may be an essential posttranslational modification of ENAM and is required for the interaction with other enamel matrix molecules such as ameloblastin in mediating the structural organization of enamel matrix and protein-mineral interactions during enamel formation.International Journal of Oral Science (2017) 9;e4; doi:10.1038/ijos.2017.41; published online 29 November 2017.
中文翻译:

釉质形成中釉蛋白中潜在的磷酸化位点的重要性。
Enamelin(ENAM)具有三个推定的磷酸丝氨酸(pSers),它们基于其独特的Ser-x-Glu(SxE)基序被高尔基体相关的分泌途径激酶(FAM20C)磷酸化。Fam20C基因敲除小鼠显示出严重的牙釉质缺陷,类似于Enam基因敲除小鼠,表明pSers在ENAM中具有重要作用。为了确定pSer 55在ENAM中的作用,我们鉴定了ENAM Rgsc514小鼠,其中Ser 55由于E 57 > G 57而不能被FAM20C磷酸化SxE基序中的突变。通过扫描电子显微镜检查了4周龄小鼠的牙釉质显微结构。通过组织学和免疫组织化学表征6日龄小鼠的牙齿。使用抗ENAM,成釉细胞蛋白和釉原蛋白的抗体,通过Western免疫印迹法分析了4日龄小鼠的第一个下臼齿的蛋白裂解物。ENAM Rgsc514杂合子显示出混乱的牙釉质微观结构,而纯合子在牙本质表面上没有牙釉质。杂合子中ENAM的N末端片段被保留在成釉细胞中,并位于釉质基质的矿化前沿,而WT小鼠的这些则从成釉细胞中分泌出来并均匀地分布在釉质基质的外部1/2中。令人惊讶地,在纯合子的摩尔裂解物中未检测到成釉细胞蛋白的〜15kDa C-末端片段。这些结果表明Ser 55的磷酸化可能是ENAM必不可少的翻译后修饰,是与其他釉质基质分子(例如成釉细胞蛋白)相互作用的必需介质,可在釉质形成过程中介导釉质基质的结构组织和蛋白质-矿物质相互作用。国际口腔科学杂志(2017)9; e4 ; doi:10.1038 / ijos.2017.41; 于2017年11月29日在线发布。
更新日期:2019-01-26
中文翻译:

釉质形成中釉蛋白中潜在的磷酸化位点的重要性。
Enamelin(ENAM)具有三个推定的磷酸丝氨酸(pSers),它们基于其独特的Ser-x-Glu(SxE)基序被高尔基体相关的分泌途径激酶(FAM20C)磷酸化。Fam20C基因敲除小鼠显示出严重的牙釉质缺陷,类似于Enam基因敲除小鼠,表明pSers在ENAM中具有重要作用。为了确定pSer 55在ENAM中的作用,我们鉴定了ENAM Rgsc514小鼠,其中Ser 55由于E 57 > G 57而不能被FAM20C磷酸化SxE基序中的突变。通过扫描电子显微镜检查了4周龄小鼠的牙釉质显微结构。通过组织学和免疫组织化学表征6日龄小鼠的牙齿。使用抗ENAM,成釉细胞蛋白和釉原蛋白的抗体,通过Western免疫印迹法分析了4日龄小鼠的第一个下臼齿的蛋白裂解物。ENAM Rgsc514杂合子显示出混乱的牙釉质微观结构,而纯合子在牙本质表面上没有牙釉质。杂合子中ENAM的N末端片段被保留在成釉细胞中,并位于釉质基质的矿化前沿,而WT小鼠的这些则从成釉细胞中分泌出来并均匀地分布在釉质基质的外部1/2中。令人惊讶地,在纯合子的摩尔裂解物中未检测到成釉细胞蛋白的〜15kDa C-末端片段。这些结果表明Ser 55的磷酸化可能是ENAM必不可少的翻译后修饰,是与其他釉质基质分子(例如成釉细胞蛋白)相互作用的必需介质,可在釉质形成过程中介导釉质基质的结构组织和蛋白质-矿物质相互作用。国际口腔科学杂志(2017)9; e4 ; doi:10.1038 / ijos.2017.41; 于2017年11月29日在线发布。































 京公网安备 11010802027423号
京公网安备 11010802027423号