当前位置:
X-MOL 学术
›
Exp. Mol. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
E3泛素连接酶TRIM25通过蛋白酶体介导的PPARγ降解来调节脂肪细胞的分化。
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2018-Oct-15 , DOI: 10.1038/s12276-018-0162-6
Jae Min Lee , Sun Sil Choi , Yo Han Lee , Keon Woo Khim , Sora Yoon , Byung-gyu Kim , Dougu Nam , Pann-Ghill Suh , Kyungjae Myung , Jang Hyun Choi
Experimental & Molecular Medicine ( IF 9.5 ) Pub Date : 2018-Oct-15 , DOI: 10.1038/s12276-018-0162-6
Jae Min Lee , Sun Sil Choi , Yo Han Lee , Keon Woo Khim , Sora Yoon , Byung-gyu Kim , Dougu Nam , Pann-Ghill Suh , Kyungjae Myung , Jang Hyun Choi
|
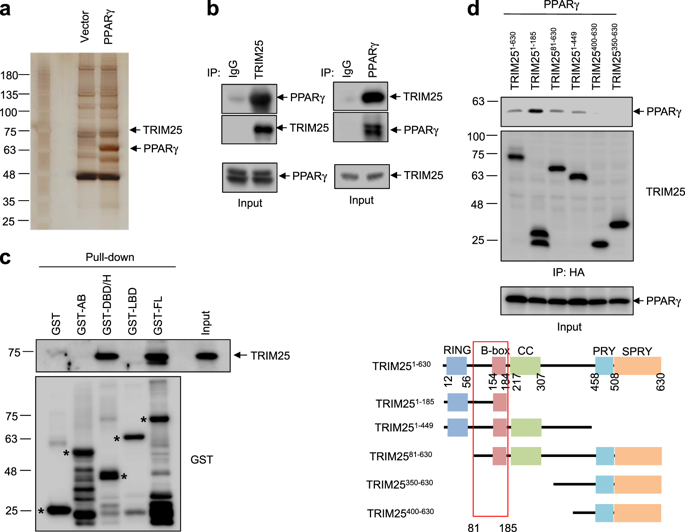
过氧化物酶体增殖物激活受体γ(PPARγ)是调节脂肪细胞分化和葡萄糖稳态的配体依赖性转录因子。PPARγ的转录活性不仅受配体调控,而且受翻译后修饰(PTM)调控。在这项研究中,我们证明了PPARγ的新型E3连接酶,即包含三重基序的25(TRIM25),可直接诱导PPARγ的泛素化,从而导致其蛋白酶体依赖性降解。在脂肪细胞分化过程中,TRIM25 mRNA和蛋白表达均显着下降,且与PPARγ的表达呈负相关。TRIM25的稳定表达降低了3T3-L1细胞的PPARγ蛋白水平并抑制了脂肪细胞的分化。相比之下,TRIM25的特异性敲低增加PPARγ蛋白水平并刺激脂肪细胞分化。此外,与野生型MEF相比,TRIM25敲除小鼠胚胎成纤维细胞(MEF)表现出更高的脂肪细胞分化能力。综上所述,这些数据表明TRIM25是PPARγ的新型E3泛素连接酶,而TRIM25是与PPARγ相关的代谢性疾病的新型靶标。

"点击查看英文标题和摘要"
更新日期:2019-01-26

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号