当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
IRE1α-XBP1s pathway promotes prostate cancer by activating c-MYC signaling.
Nature Communications ( IF 14.7 ) Pub Date : 2019-01-24 , DOI: 10.1038/s41467-018-08152-3 Xia Sheng 1, 2 , Hatice Zeynep Nenseth 1 , Su Qu 1 , Omer F Kuzu 1 , Turid Frahnow 3, 4 , Lukas Simon 3 , Stephanie Greene 5 , Qingping Zeng 5 , Ladan Fazli 6 , Paul S Rennie 6 , Ian G Mills 7 , Håvard Danielsen 8, 9, 10, 11 , Fabian Theis 3 , John B Patterson 5 , Yang Jin 1, 8 , Fahri Saatcioglu 1, 8
Nature Communications ( IF 14.7 ) Pub Date : 2019-01-24 , DOI: 10.1038/s41467-018-08152-3 Xia Sheng 1, 2 , Hatice Zeynep Nenseth 1 , Su Qu 1 , Omer F Kuzu 1 , Turid Frahnow 3, 4 , Lukas Simon 3 , Stephanie Greene 5 , Qingping Zeng 5 , Ladan Fazli 6 , Paul S Rennie 6 , Ian G Mills 7 , Håvard Danielsen 8, 9, 10, 11 , Fabian Theis 3 , John B Patterson 5 , Yang Jin 1, 8 , Fahri Saatcioglu 1, 8
Affiliation
|
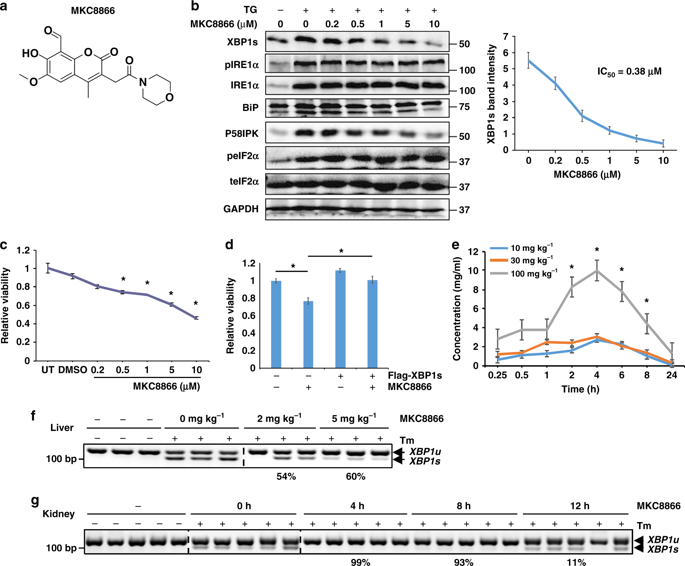
Activation of endoplasmic reticulum (ER) stress/the unfolded protein response (UPR) has been linked to cancer, but the molecular mechanisms are poorly understood and there is a paucity of reagents to translate this for cancer therapy. Here, we report that an IRE1α RNase-specific inhibitor, MKC8866, strongly inhibits prostate cancer (PCa) tumor growth as monotherapy in multiple preclinical models in mice and shows synergistic antitumor effects with current PCa drugs. Interestingly, global transcriptomic analysis reveal that IRE1α-XBP1s pathway activity is required for c-MYC signaling, one of the most highly activated oncogenic pathways in PCa. XBP1s is necessary for optimal c-MYC mRNA and protein expression, establishing, for the first time, a direct link between UPR and oncogene activation. In addition, an XBP1-specific gene expression signature is strongly associated with PCa prognosis. Our data establish IRE1α-XBP1s signaling as a central pathway in PCa and indicate that its targeting may offer novel treatment strategies.
中文翻译:

IRE1α-XBP1s 通路通过激活 c-MYC 信号传导促进前列腺癌。
内质网 (ER) 应激/未折叠蛋白反应 (UPR) 的激活与癌症有关,但人们对其分子机制知之甚少,并且缺乏将其转化为癌症治疗的试剂。在这里,我们报道了一种 IRE1α RNase 特异性抑制剂 MKC8866,在小鼠的多个临床前模型中作为单一疗法强烈抑制前列腺癌 (PCa) 肿瘤生长,并与现有 PCa 药物显示出协同抗肿瘤作用。有趣的是,全局转录组分析表明,IRE1α-XBP1s 通路活性是 c-MYC 信号传导所必需的,c-MYC 信号传导是 PCa 中最高度激活的致癌通路之一。 XBP1s 对于最佳 c-MYC mRNA 和蛋白质表达是必需的,首次建立了 UPR 和癌基因激活之间的直接联系。此外,XBP1 特异性基因表达特征与 PCa 预后密切相关。我们的数据将 IRE1α-XBP1s 信号转导确定为 PCa 的中心通路,并表明其靶向可能提供新的治疗策略。
更新日期:2019-01-24
中文翻译:

IRE1α-XBP1s 通路通过激活 c-MYC 信号传导促进前列腺癌。
内质网 (ER) 应激/未折叠蛋白反应 (UPR) 的激活与癌症有关,但人们对其分子机制知之甚少,并且缺乏将其转化为癌症治疗的试剂。在这里,我们报道了一种 IRE1α RNase 特异性抑制剂 MKC8866,在小鼠的多个临床前模型中作为单一疗法强烈抑制前列腺癌 (PCa) 肿瘤生长,并与现有 PCa 药物显示出协同抗肿瘤作用。有趣的是,全局转录组分析表明,IRE1α-XBP1s 通路活性是 c-MYC 信号传导所必需的,c-MYC 信号传导是 PCa 中最高度激活的致癌通路之一。 XBP1s 对于最佳 c-MYC mRNA 和蛋白质表达是必需的,首次建立了 UPR 和癌基因激活之间的直接联系。此外,XBP1 特异性基因表达特征与 PCa 预后密切相关。我们的数据将 IRE1α-XBP1s 信号转导确定为 PCa 的中心通路,并表明其靶向可能提供新的治疗策略。















































 京公网安备 11010802027423号
京公网安备 11010802027423号