当前位置:
X-MOL 学术
›
Am. J. Hum. Genet.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Complex Compound Inheritance of Lethal Lung Developmental Disorders Due to Disruption of the TBX-FGF Pathway.
American Journal of Human Genetics ( IF 8.1 ) Pub Date : 2019-01-10 , DOI: 10.1016/j.ajhg.2018.12.010
Justyna A Karolak 1 , Marie Vincent 2 , Gail Deutsch 3 , Tomasz Gambin 4 , Benjamin Cogné 2 , Olivier Pichon 5 , Francesco Vetrini 6 , Heather C Mefford 7 , Jennifer N Dines 8 , Katie Golden-Grant 9 , Katrina Dipple 10 , Amanda S Freed 8 , Kathleen A Leppig 11 , Megan Dishop 12 , David Mowat 13 , Bruce Bennetts 14 , Andrew J Gifford 15 , Martin A Weber 16 , Anna F Lee 17 , Cornelius F Boerkoel 18 , Tina M Bartell 19 , Catherine Ward-Melver 20 , Thomas Besnard 2 , Florence Petit 21 , Iben Bache 22 , Zeynep Tümer 23 , Marie Denis-Musquer 24 , Madeleine Joubert 24 , Jelena Martinovic 25 , Claire Bénéteau 2 , Arnaud Molin 26 , Dominique Carles 27 , Gwenaelle André 27 , Eric Bieth 28 , Nicolas Chassaing 28 , Louise Devisme 29 , Lara Chalabreysse 30 , Laurent Pasquier 31 , Véronique Secq 32 , Massimiliano Don 33 , Maria Orsaria 34 , Chantal Missirian 35 , Jérémie Mortreux 35 , Damien Sanlaville 36 , Linda Pons 36 , Sébastien Küry 2 , Stéphane Bézieau 2 , Jean-Michel Liet 37 , Nicolas Joram 37 , Tiphaine Bihouée 38 , Daryl A Scott 39 , Chester W Brown 40 , Fernando Scaglia 41 , Anne Chun-Hui Tsai 42 , Dorothy K Grange 43 , John A Phillips 44 , Jean P Pfotenhauer 44 , Shalini N Jhangiani 45 , Claudia G Gonzaga-Jauregui 46 , Wendy K Chung 47 , Galen M Schauer 48 , Mark H Lipson 19 , Catherine L Mercer 49 , Arie van Haeringen 50 , Qian Liu 51 , Edwina Popek 52 , Zeynep H Coban Akdemir 51 , James R Lupski 53 , Przemyslaw Szafranski 51 , Bertrand Isidor 2 , Cedric Le Caignec 5 , Paweł Stankiewicz 54
American Journal of Human Genetics ( IF 8.1 ) Pub Date : 2019-01-10 , DOI: 10.1016/j.ajhg.2018.12.010
Justyna A Karolak 1 , Marie Vincent 2 , Gail Deutsch 3 , Tomasz Gambin 4 , Benjamin Cogné 2 , Olivier Pichon 5 , Francesco Vetrini 6 , Heather C Mefford 7 , Jennifer N Dines 8 , Katie Golden-Grant 9 , Katrina Dipple 10 , Amanda S Freed 8 , Kathleen A Leppig 11 , Megan Dishop 12 , David Mowat 13 , Bruce Bennetts 14 , Andrew J Gifford 15 , Martin A Weber 16 , Anna F Lee 17 , Cornelius F Boerkoel 18 , Tina M Bartell 19 , Catherine Ward-Melver 20 , Thomas Besnard 2 , Florence Petit 21 , Iben Bache 22 , Zeynep Tümer 23 , Marie Denis-Musquer 24 , Madeleine Joubert 24 , Jelena Martinovic 25 , Claire Bénéteau 2 , Arnaud Molin 26 , Dominique Carles 27 , Gwenaelle André 27 , Eric Bieth 28 , Nicolas Chassaing 28 , Louise Devisme 29 , Lara Chalabreysse 30 , Laurent Pasquier 31 , Véronique Secq 32 , Massimiliano Don 33 , Maria Orsaria 34 , Chantal Missirian 35 , Jérémie Mortreux 35 , Damien Sanlaville 36 , Linda Pons 36 , Sébastien Küry 2 , Stéphane Bézieau 2 , Jean-Michel Liet 37 , Nicolas Joram 37 , Tiphaine Bihouée 38 , Daryl A Scott 39 , Chester W Brown 40 , Fernando Scaglia 41 , Anne Chun-Hui Tsai 42 , Dorothy K Grange 43 , John A Phillips 44 , Jean P Pfotenhauer 44 , Shalini N Jhangiani 45 , Claudia G Gonzaga-Jauregui 46 , Wendy K Chung 47 , Galen M Schauer 48 , Mark H Lipson 19 , Catherine L Mercer 49 , Arie van Haeringen 50 , Qian Liu 51 , Edwina Popek 52 , Zeynep H Coban Akdemir 51 , James R Lupski 53 , Przemyslaw Szafranski 51 , Bertrand Isidor 2 , Cedric Le Caignec 5 , Paweł Stankiewicz 54
Affiliation
|
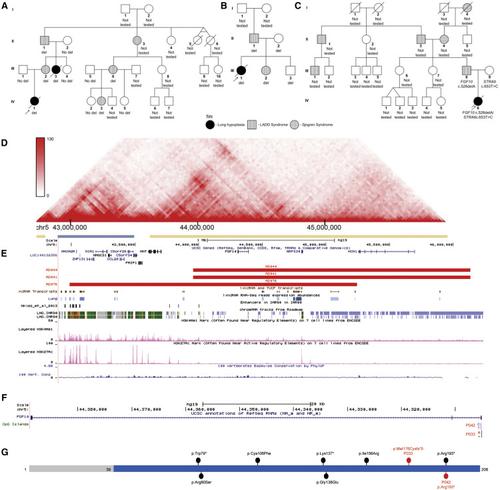
Primary defects in lung branching morphogenesis, resulting in neonatal lethal pulmonary hypoplasias, are incompletely understood. To elucidate the pathogenetics of human lung development, we studied a unique collection of samples obtained from deceased individuals with clinically and histopathologically diagnosed interstitial neonatal lung disorders: acinar dysplasia (n = 14), congenital alveolar dysplasia (n = 2), and other lethal lung hypoplasias (n = 10). We identified rare heterozygous copy-number variant deletions or single-nucleotide variants (SNVs) involvingTBX4(n = 8 and n = 2, respectively) orFGF10(n = 2 and n = 2, respectively) in 16/26 (61%) individuals. In addition toTBX4, the overlapping ∼2 Mb recurrent and nonrecurrent deletions at 17q23.1q23.2 identified in seven individuals with lung hypoplasia also remove a lung-specific enhancer region. Individuals with coding variants involving eitherTBX4orFGF10also harbored at least one non-coding SNV in the predicted lung-specific enhancer region, which was absent in 13 control individuals with the overlapping deletions but without any structural lung anomalies. The occurrence of rare coding variants involvingTBX4orFGF10with the putative hypomorphic non-coding SNVs implies a complex compound inheritance of these pulmonary hypoplasias. Moreover, they support the importance of TBX4-FGF10-FGFR2 epithelial-mesenchymal signaling in human lung organogenesis and help to explain the histopathological continuum observed in these rare lethal developmental disorders of the lung.
中文翻译:

TBX-FGF途径中断导致致死性肺发育障碍的复杂复合遗传。
肺分支形态发生的主要缺陷,导致新生儿致命性肺发育不全,目前尚不完全清楚。为了阐明人肺发育的病原学,我们研究了一组从临床和组织病理学诊断为间质性新生儿肺部疾病的已故个体中收集的独特样本:腺泡发育不良(n = 14),先天性肺泡发育不良(n = 2)和其他致命性疾病肺发育不全(n = 10)。我们在16/26(61%)的个体中发现了涉及TBX4(分别为n = 8和n = 2)或FGF10(分别为n = 2和n = 2)的罕见杂合拷贝数变异或单核苷酸变异(SNV)。 。除TBX4外,在17q23.1q23处重叠的〜2 Mb重复和非重复删除。在七个肺发育不全的个体中鉴定出的2个也去除了肺特异性增强子区域。具有涉及TBX4或FGF10的编码变体的个体在预测的肺特异性增强子区域中也包含至少一个非编码SNV,在缺失重叠但没有任何结构性肺异常的13个对照个体中不存在。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。具有涉及TBX4或FGF10的编码变体的个体在预测的肺特异性增强子区域中也包含至少一个非编码SNV,在缺失重叠但没有任何结构性肺异常的13个对照个体中不存在。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。具有涉及TBX4或FGF10的编码变体的个体在预测的肺特异性增强子区域中也包含至少一个非编码SNV,在缺失重叠但没有任何结构性肺异常的13个对照个体中不存在。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。在缺失重叠但没有任何结构性肺部异常的13个对照个体中,这是缺失的。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。在缺失重叠但没有任何结构性肺部异常的13个对照个体中,这是缺失的。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。
更新日期:2019-01-11
中文翻译:

TBX-FGF途径中断导致致死性肺发育障碍的复杂复合遗传。
肺分支形态发生的主要缺陷,导致新生儿致命性肺发育不全,目前尚不完全清楚。为了阐明人肺发育的病原学,我们研究了一组从临床和组织病理学诊断为间质性新生儿肺部疾病的已故个体中收集的独特样本:腺泡发育不良(n = 14),先天性肺泡发育不良(n = 2)和其他致命性疾病肺发育不全(n = 10)。我们在16/26(61%)的个体中发现了涉及TBX4(分别为n = 8和n = 2)或FGF10(分别为n = 2和n = 2)的罕见杂合拷贝数变异或单核苷酸变异(SNV)。 。除TBX4外,在17q23.1q23处重叠的〜2 Mb重复和非重复删除。在七个肺发育不全的个体中鉴定出的2个也去除了肺特异性增强子区域。具有涉及TBX4或FGF10的编码变体的个体在预测的肺特异性增强子区域中也包含至少一个非编码SNV,在缺失重叠但没有任何结构性肺异常的13个对照个体中不存在。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。具有涉及TBX4或FGF10的编码变体的个体在预测的肺特异性增强子区域中也包含至少一个非编码SNV,在缺失重叠但没有任何结构性肺异常的13个对照个体中不存在。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。具有涉及TBX4或FGF10的编码变体的个体在预测的肺特异性增强子区域中也包含至少一个非编码SNV,在缺失重叠但没有任何结构性肺异常的13个对照个体中不存在。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。在缺失重叠但没有任何结构性肺部异常的13个对照个体中,这是缺失的。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。在缺失重叠但没有任何结构性肺部异常的13个对照个体中,这是缺失的。涉及TBX4或FGF10并伴有假定的亚型非编码SNV的罕见编码变体的出现暗示了这些肺发育不全的复杂化合物遗传。此外,它们支持TBX4-FGF10-FGFR2上皮间质信号传导在人肺器官发生中的重要性,并有助于解释在这些罕见的致命性肺发育疾病中观察到的组织病理学连续性。







































 京公网安备 11010802027423号
京公网安备 11010802027423号