Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
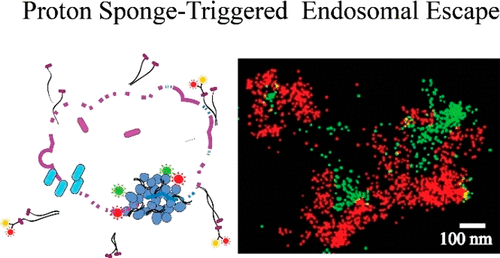
质子海绵触发的内体破裂和小干扰RNA的胞质释放的超分辨率成像。
ACS Nano ( IF 15.8 ) Pub Date : 2019-01-02 , DOI: 10.1021/acsnano.8b05151 Marcin Wojnilowicz 1 , Agata Glab 1 , Alessandro Bertucci 1, 2 , Frank Caruso 1 , Francesca Cavalieri 1, 2
ACS Nano ( IF 15.8 ) Pub Date : 2019-01-02 , DOI: 10.1021/acsnano.8b05151 Marcin Wojnilowicz 1 , Agata Glab 1 , Alessandro Bertucci 1, 2 , Frank Caruso 1 , Francesca Cavalieri 1, 2
Affiliation
|
核酸和蛋白质的细胞内递送仍然是生物疗法发展中的关键挑战。在基因治疗中,脂质体或多聚体将小干扰RNA(siRNA)传递至胞质溶胶的效率低下通常归因于siRNA负载在内体区室中的捕获和降解。多聚体破裂内体膜并释放其核酸物质的可能机制通常被定义为“质子海绵效应”。这是由复合物的质子缓冲能力触发的渗透驱动过程。在这里,我们通过直接可视化siRNA运输过程来研究“质子海绵效应”的分子基础,包括对单个多链体和内体的分析,使用随机光学重建显微镜。我们通过对亚细胞结构,多链体和沉默RNA分子的单分子超分辨率分析,探讨了依次进行的siRNA运输步骤。具体而言,检查了内体破裂,受损的内体囊泡以及胞质中的多聚体解体后在胞质溶胶中释放的单个完整多聚体。我们发现多链体的体系结构和阳离子聚合物链的刚性是控制质子海绵效应驱动的内体逃逸机制的关键参数。我们提供的证据表明,在固定在二氧化硅纳米颗粒上的高度支化和刚性的阳离子聚合物(例如糖原或聚乙烯亚胺)中,质子海绵效应可有效诱导内体的渗透性溶胀和破裂。我们通过对亚细胞结构,多链体和沉默RNA分子的单分子超分辨率分析,探讨了依次进行的siRNA运输步骤。具体而言,检查了内体破裂,受损的内体囊泡以及胞质中的多聚体解体后在胞质溶胶中释放的单个完整多聚体。我们发现多链体的体系结构和阳离子聚合物链的刚性是控制质子海绵效应驱动的内体逃逸机制的关键参数。我们提供的证据表明,在固定在二氧化硅纳米颗粒上的高度支化和刚性的阳离子聚合物(例如糖原或聚乙烯亚胺)中,质子海绵效应可有效诱导内体的渗透性溶胀和破裂。我们通过对亚细胞结构,多链体和沉默RNA分子的单分子超分辨率分析,探讨了依次进行的siRNA运输步骤。具体而言,检查了内体破裂,受损的内体囊泡以及胞质中的多聚体解体后在胞质溶胶中释放的单个完整多聚体。我们发现多链体的体系结构和阳离子聚合物链的刚性是控制质子海绵效应驱动的内体逃逸机制的关键参数。我们提供的证据表明,在固定在二氧化硅纳米颗粒上的高度分支和刚性的阳离子聚合物(如糖原或聚乙烯亚胺)中,质子海绵效应可有效地诱导内体的渗透性溶胀和破裂。

"点击查看英文标题和摘要"
更新日期:2018-12-19

"点击查看英文标题和摘要"





















































 京公网安备 11010802027423号
京公网安备 11010802027423号