当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Identification of G-Quadruplex-Binding Protein from the Exploration of RGG Motif/G-Quadruplex Interactions
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2018-12-05 , DOI: 10.1021/jacs.8b09329 Zhou-Li Huang 1 , Jing Dai 1 , Wen-Hua Luo 1 , Xiang-Gui Wang 1 , Jia-Heng Tan 1 , Shuo-Bin Chen 1 , Zhi-Shu Huang 1
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2018-12-05 , DOI: 10.1021/jacs.8b09329 Zhou-Li Huang 1 , Jing Dai 1 , Wen-Hua Luo 1 , Xiang-Gui Wang 1 , Jia-Heng Tan 1 , Shuo-Bin Chen 1 , Zhi-Shu Huang 1
Affiliation
|
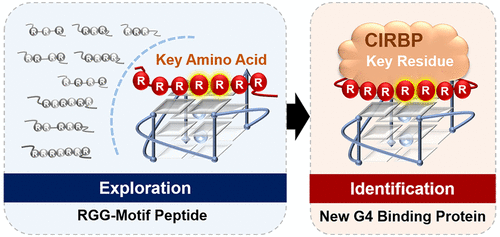
The arginine/glycine-rich region termed the RGG domain is usually found in G-quadruplex (G4)-binding proteins and is important in G4-protein interactions. Studies on the binding mechanism of RGG domains found that small segments (RGG motif) inside the domain contribute greatly to the G4 binding affinity. However, unlike the entire RGG domains that have been broadly explored, the role of the RGG motif remains obscure, with very limited study. Herein, to clarify the role of the RGG motif in G4-protein interactions, we systematically investigated the binding affinity and mode between RGG-motif peptides and G4s. The internal arrangement of RGG repeats and gap amino acids played a more crucial role in the G4-binding mechanism than a critical number of RGG repeats. Arginines and phenylalanines at the exact position of the RGG motif might enable additional hydrogen bonding and π-stacking interaction with nucleobases and strengthen the binding of G4. Impressively, proceeding from a G4-binding RGG peptide, 12, discovered above, we identified the cold-inducible RNA-binding protein (CIRBP) as a new G4 DNA-binding protein both in vitro and in cells. In addition, we found that the key amino acids for G4 binding in peptide 12 and CIRBP were highly similar, and peptide 12 clearly played a key role in the G4 binding of CIRBP. This report is the first in which a G4-binding protein was identified from exploration of the G4-binding RGG motif. Our findings suggest a novel strategy for discovering new G4-binding proteins by exploring key peptide segments.
中文翻译:

从 RGG 基序/G-四链体相互作用的探索中鉴定 G-四链体结合蛋白
称为 RGG 结构域的富含精氨酸/甘氨酸的区域通常存在于 G-四链体 (G4) 结合蛋白中,并且在 G4 蛋白相互作用中很重要。对 RGG 域结合机制的研究发现,域内的小片段(RGG 基序)对 G4 结合亲和力有很大贡献。然而,与已被广泛探索的整个 RGG 域不同,RGG 基序的作用仍然模糊不清,研究非常有限。在此,为了阐明 RGG 基序在 G4 蛋白相互作用中的作用,我们系统地研究了 RGG 基序肽和 G4 之间的结合亲和力和模式。RGG 重复序列和缺口氨基酸的内部排列在 G4 结合机制中比关键数量的 RGG 重复序列更重要。RGG 基序的确切位置处的精氨酸和苯丙氨酸可能会与核碱基形成额外的氢键和 π 堆积相互作用,并加强 G4 的结合。令人印象深刻的是,从上面发现的 G4 结合 RGG 肽 12 开始,我们在体外和细胞中鉴定出冷诱导 RNA 结合蛋白 (CIRBP) 作为一种新的 G4 DNA 结合蛋白。此外,我们发现肽12和CIRBP中G4结合的关键氨基酸高度相似,肽12显然在CIRBP的G4结合中起关键作用。这份报告是第一个从 G4 结合 RGG 基序的探索中鉴定出 G4 结合蛋白的报告。我们的研究结果提出了一种通过探索关键肽段来发现新 G4 结合蛋白的新策略。
更新日期:2018-12-05
中文翻译:

从 RGG 基序/G-四链体相互作用的探索中鉴定 G-四链体结合蛋白
称为 RGG 结构域的富含精氨酸/甘氨酸的区域通常存在于 G-四链体 (G4) 结合蛋白中,并且在 G4 蛋白相互作用中很重要。对 RGG 域结合机制的研究发现,域内的小片段(RGG 基序)对 G4 结合亲和力有很大贡献。然而,与已被广泛探索的整个 RGG 域不同,RGG 基序的作用仍然模糊不清,研究非常有限。在此,为了阐明 RGG 基序在 G4 蛋白相互作用中的作用,我们系统地研究了 RGG 基序肽和 G4 之间的结合亲和力和模式。RGG 重复序列和缺口氨基酸的内部排列在 G4 结合机制中比关键数量的 RGG 重复序列更重要。RGG 基序的确切位置处的精氨酸和苯丙氨酸可能会与核碱基形成额外的氢键和 π 堆积相互作用,并加强 G4 的结合。令人印象深刻的是,从上面发现的 G4 结合 RGG 肽 12 开始,我们在体外和细胞中鉴定出冷诱导 RNA 结合蛋白 (CIRBP) 作为一种新的 G4 DNA 结合蛋白。此外,我们发现肽12和CIRBP中G4结合的关键氨基酸高度相似,肽12显然在CIRBP的G4结合中起关键作用。这份报告是第一个从 G4 结合 RGG 基序的探索中鉴定出 G4 结合蛋白的报告。我们的研究结果提出了一种通过探索关键肽段来发现新 G4 结合蛋白的新策略。































 京公网安备 11010802027423号
京公网安备 11010802027423号