当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Proteome-wide analysis of USP14 substrates revealed its role in hepatosteatosis via stabilization of FASN.
Nature Communications ( IF 14.7 ) Pub Date : 2018-11-13 , DOI: 10.1038/s41467-018-07185-y Bin Liu , Shangwen Jiang , Min Li , Xuelian Xiong , Mingrui Zhu , Duanzhuo Li , Lei Zhao , Lili Qian , Linhui Zhai , Jing Li , Han Lu , Shengnan Sun , Jiandie Lin , Yan Lu , Xiaoying Li , Minjia Tan
Nature Communications ( IF 14.7 ) Pub Date : 2018-11-13 , DOI: 10.1038/s41467-018-07185-y Bin Liu , Shangwen Jiang , Min Li , Xuelian Xiong , Mingrui Zhu , Duanzhuo Li , Lei Zhao , Lili Qian , Linhui Zhai , Jing Li , Han Lu , Shengnan Sun , Jiandie Lin , Yan Lu , Xiaoying Li , Minjia Tan
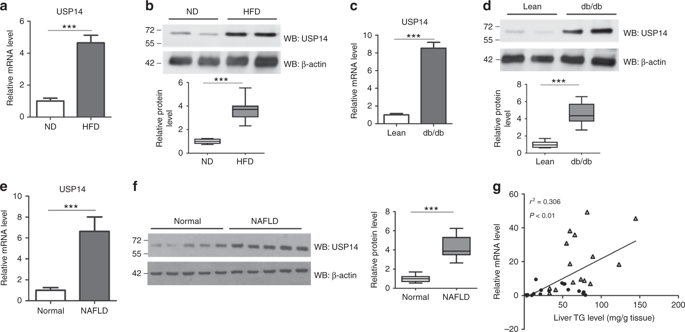
|
Ubiquitin-specific protease 14 (USP14) is one of the major proteasome-associated deubiquitinating enzymes critical for proteome homeostasis. However, substrates of USP14 remain largely unknown, hindering the understanding of its functional roles. Here we conduct a comprehensive proteome, ubiquitinome and interactome analysis for USP14 substrate screening. Bioinformatics analysis reveals broad new potential roles of USP14, especially in lipid and carbohydrate metabolism. Among the potential substrates identified, we show that fatty acid synthase (FASN), a key enzyme involved in hepatic lipogenesis, is a bona fide substrate of USP14. USP14 directly interacts with and increases FASN stability. As a result, overexpression of USP14 promotes liver triglyceride accumulation in C57BL/6 mice, whereas genetic ablation or pharmacological inhibition of USP14 ameliorates hepatosteatosis, hyperglycemia and insulin resistance in obese mice. In conclusion, our findings reveal for the first time an indispensable role of USP14 in hepatosteatosis through FASN stabilization.
中文翻译:

对USP14底物的全蛋白质组分析表明,它通过稳定FASN在肝脂肪变性中发挥作用。
泛素特异性蛋白酶14(USP14)是对蛋白质组稳态至关重要的主要蛋白酶体相关的去泛素化酶之一。但是,USP14的底物在很大程度上仍然未知,这妨碍了对其功能作用的理解。在这里,我们对USP14底物筛选进行了全面的蛋白质组,泛素组和相互作用组分析。生物信息学分析揭示了USP14广泛的潜在新作用,尤其是在脂质和碳水化合物的代谢中。在确定的潜在底物中,我们显示出脂肪酸合酶(FASN),一种参与肝脂肪形成的关键酶,是USP14的真正底物。USP14直接与FASN交互并增加其稳定性。结果,USP14的过表达促进了C57BL / 6小鼠肝甘油三酸酯的积累,而USP14的遗传消融或药理抑制作用可改善肥胖小鼠的肝脂肪变性,高血糖症和胰岛素抵抗。总之,我们的发现首次揭示了USP14通过FASN稳定在肝脂肪变性中不可或缺的作用。
更新日期:2018-11-13
中文翻译:

对USP14底物的全蛋白质组分析表明,它通过稳定FASN在肝脂肪变性中发挥作用。
泛素特异性蛋白酶14(USP14)是对蛋白质组稳态至关重要的主要蛋白酶体相关的去泛素化酶之一。但是,USP14的底物在很大程度上仍然未知,这妨碍了对其功能作用的理解。在这里,我们对USP14底物筛选进行了全面的蛋白质组,泛素组和相互作用组分析。生物信息学分析揭示了USP14广泛的潜在新作用,尤其是在脂质和碳水化合物的代谢中。在确定的潜在底物中,我们显示出脂肪酸合酶(FASN),一种参与肝脂肪形成的关键酶,是USP14的真正底物。USP14直接与FASN交互并增加其稳定性。结果,USP14的过表达促进了C57BL / 6小鼠肝甘油三酸酯的积累,而USP14的遗传消融或药理抑制作用可改善肥胖小鼠的肝脂肪变性,高血糖症和胰岛素抵抗。总之,我们的发现首次揭示了USP14通过FASN稳定在肝脂肪变性中不可或缺的作用。


















































 京公网安备 11010802027423号
京公网安备 11010802027423号