Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
The α2δ-like Protein Cachd1 Increases N-type Calcium Currents and Cell Surface Expression and Competes with α2δ-1.
Cell Reports ( IF 7.5 ) Pub Date : 2018-11-06 , DOI: 10.1016/j.celrep.2018.10.033 Shehrazade Dahimene 1 , Karen M Page 1 , Ivan Kadurin 1 , Laurent Ferron 1 , Dominique Y Ho 1 , Gareth T Powell 2 , Wendy S Pratt 1 , Stephen W Wilson 2 , Annette C Dolphin 1
Cell Reports ( IF 7.5 ) Pub Date : 2018-11-06 , DOI: 10.1016/j.celrep.2018.10.033 Shehrazade Dahimene 1 , Karen M Page 1 , Ivan Kadurin 1 , Laurent Ferron 1 , Dominique Y Ho 1 , Gareth T Powell 2 , Wendy S Pratt 1 , Stephen W Wilson 2 , Annette C Dolphin 1
Affiliation
|
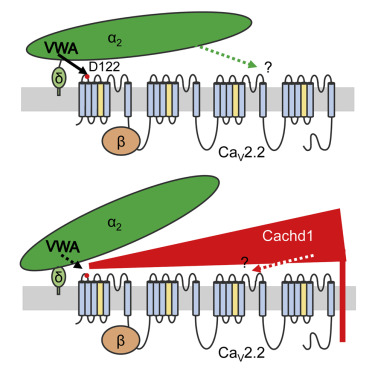
Voltage-gated calcium channel auxiliary α2δ subunits are important for channel trafficking and function. Here, we compare the effects of α2δ-1 and an α2δ-like protein called Cachd1 on neuronal N-type (CaV2.2) channels, which are important in neurotransmission. Previous structural studies show the α2δ-1 VWA domain interacting with the first loop in CaV1.1 domain-I via its metal ion-dependent adhesion site (MIDAS) motif and additional Cache domain interactions. Cachd1 has a disrupted MIDAS motif. However, Cachd1 increases CaV2.2 currents substantially (although less than α2δ-1) and increases CaV2.2 cell surface expression by reducing endocytosis. Although the effects of α2δ-1 are abolished by mutation of Asp122 in CaV2.2 domain-I, which mediates interaction with its VWA domain, the Cachd1 responses are unaffected. Furthermore, Cachd1 co-immunoprecipitates with CaV2.2 and inhibits co-immunoprecipitation of α2δ-1 by CaV2.2. Cachd1 also competes with α2δ-1 for effects on trafficking. Thus, Cachd1 influences both CaV2.2 trafficking and function and can inhibit responses to α2δ-1.
中文翻译:

α2δ 样蛋白 Cachd1 增加 N 型钙电流和细胞表面表达,并与 α2δ-1 竞争。
电压门控钙通道辅助 α2δ 亚基对于通道运输和功能很重要。在这里,我们比较了 α2δ-1 和一种称为 Cachd1 的 α2δ 样蛋白对神经元 N 型 (CaV2.2) 通道的影响,这在神经传递中很重要。先前的结构研究表明,α2δ-1 VWA 结构域通过其金属离子依赖性粘附位点 (MIDAS) 基序和其他缓存结构域相互作用与 CaV1.1 结构域-I 中的第一个环相互作用。Cachd1 有一个中断的 MIDAS 基序。然而,Cachd1 显着增加 CaV2.2 电流(尽管小于 α2δ-1)并通过减少内吞作用增加 CaV2.2 细胞表面表达。尽管 α2δ-1 的作用被 CaV2.2 结构域-I 中的 Asp122 突变所消除,它介导与其 VWA 结构域的相互作用,但 Cachd1 响应不受影响。此外,Cachd1 与 CaV2.2 共免疫沉淀并抑制 CaV2.2 对 α2δ-1 的共免疫沉淀。Cachd1 还与 α2δ-1 竞争对贩运的影响。因此,Cachd1 影响 CaV2.2 运输和功能,并且可以抑制对 α2δ-1 的反应。
更新日期:2018-11-07
中文翻译:

α2δ 样蛋白 Cachd1 增加 N 型钙电流和细胞表面表达,并与 α2δ-1 竞争。
电压门控钙通道辅助 α2δ 亚基对于通道运输和功能很重要。在这里,我们比较了 α2δ-1 和一种称为 Cachd1 的 α2δ 样蛋白对神经元 N 型 (CaV2.2) 通道的影响,这在神经传递中很重要。先前的结构研究表明,α2δ-1 VWA 结构域通过其金属离子依赖性粘附位点 (MIDAS) 基序和其他缓存结构域相互作用与 CaV1.1 结构域-I 中的第一个环相互作用。Cachd1 有一个中断的 MIDAS 基序。然而,Cachd1 显着增加 CaV2.2 电流(尽管小于 α2δ-1)并通过减少内吞作用增加 CaV2.2 细胞表面表达。尽管 α2δ-1 的作用被 CaV2.2 结构域-I 中的 Asp122 突变所消除,它介导与其 VWA 结构域的相互作用,但 Cachd1 响应不受影响。此外,Cachd1 与 CaV2.2 共免疫沉淀并抑制 CaV2.2 对 α2δ-1 的共免疫沉淀。Cachd1 还与 α2δ-1 竞争对贩运的影响。因此,Cachd1 影响 CaV2.2 运输和功能,并且可以抑制对 α2δ-1 的反应。






























 京公网安备 11010802027423号
京公网安备 11010802027423号