Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
PPARγΔ5, a Naturally Occurring Dominant-Negative Splice Isoform, Impairs PPARγ Function and Adipocyte Differentiation.
Cell Reports ( IF 7.5 ) Pub Date : 2018-11-06 , DOI: 10.1016/j.celrep.2018.10.035 Marianna Aprile 1 , Simona Cataldi 1 , Maria Rosaria Ambrosio 2 , Vittoria D'Esposito 2 , Koini Lim 3 , Arne Dietrich 4 , Matthias Blüher 5 , David Bousfield Savage 3 , Pietro Formisano 2 , Alfredo Ciccodicola 6 , Valerio Costa 1
Cell Reports ( IF 7.5 ) Pub Date : 2018-11-06 , DOI: 10.1016/j.celrep.2018.10.035 Marianna Aprile 1 , Simona Cataldi 1 , Maria Rosaria Ambrosio 2 , Vittoria D'Esposito 2 , Koini Lim 3 , Arne Dietrich 4 , Matthias Blüher 5 , David Bousfield Savage 3 , Pietro Formisano 2 , Alfredo Ciccodicola 6 , Valerio Costa 1
Affiliation
|
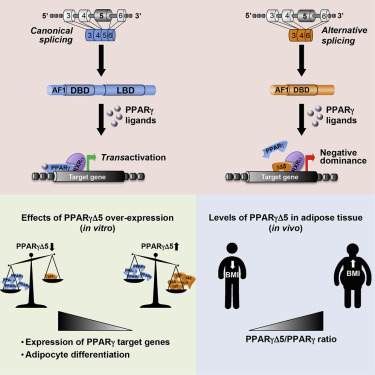
Peroxisome-proliferator-activated receptor γ (PPARγ) regulates glucose and lipid homeostasis, insulin signaling, and adipocyte differentiation. Here, we report the skipping of exon 5 as a legitimate splicing event generating PPARγΔ5, a previously unidentified naturally occurring truncated isoform of PPARγ, which lacks the entire ligand-binding domain. PPARγΔ5 is endogenously expressed in human adipose tissue and, during adipocyte differentiation, lacks ligand-dependent transactivation ability and acts as a dominant-negative isoform reducing PPARγ activity. Ligand-mediated PPARγ activation induces exon 5 skipping in a negative feedback loop, suggesting alternative splicing as a mechanism regulating PPARγ activity. PPARγΔ5 overexpression modifies the PPARγ-induced transcriptional network, significantly impairing the differentiation ability of adipocyte precursor cells. Additionally, PPARγΔ5 expression in subcutaneous adipose tissue positively correlates with BMI in two independent cohorts of overweight or obese and type 2 diabetic patients. From a functional perspective, PPARγΔ5 mimics PPARG dominant-negative mutated receptors, possibly contributing to adipose tissue dysfunction. These findings open an unexplored scenario in PPARG regulation and PPARγ-related diseases.
中文翻译:

PPARγΔ5,一种天然存在的显性-阴性剪接异构体,会损害 PPARγ 功能和脂肪细胞分化。
过氧化物酶体增殖物激活受体 γ (PPARγ) 调节葡萄糖和脂质稳态、胰岛素信号传导和脂肪细胞分化。在这里,我们报告了外显子 5 的跳跃作为产生 PPARγΔ5 的合法剪接事件,这是一种以前未鉴定的天然存在的 PPARγ 截短同种型,缺乏整个配体结合域。PPARγΔ5 在人类脂肪组织中内源性表达,在脂肪细胞分化过程中,缺乏配体依赖性反式激活能力,并作为显性负亚型降低 PPARγ 活性。配体介导的 PPARγ 激活诱导外显子 5 在负反馈回路中跳跃,表明选择性剪接是调节 PPARγ 活性的机制。PPARγΔ5 过表达改变了 PPARγ 诱导的转录网络,显着损害脂肪细胞前体细胞的分化能力。此外,皮下脂肪组织中 PPARγΔ5 的表达与超重或肥胖和 2 型糖尿病患者的两个独立队列中的 BMI 呈正相关。从功能角度来看,PPARγΔ5 模拟 PPARG 显性阴性突变受体,可能导致脂肪组织功能障碍。这些发现为 PPARG 调节和 PPARγ 相关疾病开辟了一个未探索的场景。
更新日期:2018-11-07
中文翻译:

PPARγΔ5,一种天然存在的显性-阴性剪接异构体,会损害 PPARγ 功能和脂肪细胞分化。
过氧化物酶体增殖物激活受体 γ (PPARγ) 调节葡萄糖和脂质稳态、胰岛素信号传导和脂肪细胞分化。在这里,我们报告了外显子 5 的跳跃作为产生 PPARγΔ5 的合法剪接事件,这是一种以前未鉴定的天然存在的 PPARγ 截短同种型,缺乏整个配体结合域。PPARγΔ5 在人类脂肪组织中内源性表达,在脂肪细胞分化过程中,缺乏配体依赖性反式激活能力,并作为显性负亚型降低 PPARγ 活性。配体介导的 PPARγ 激活诱导外显子 5 在负反馈回路中跳跃,表明选择性剪接是调节 PPARγ 活性的机制。PPARγΔ5 过表达改变了 PPARγ 诱导的转录网络,显着损害脂肪细胞前体细胞的分化能力。此外,皮下脂肪组织中 PPARγΔ5 的表达与超重或肥胖和 2 型糖尿病患者的两个独立队列中的 BMI 呈正相关。从功能角度来看,PPARγΔ5 模拟 PPARG 显性阴性突变受体,可能导致脂肪组织功能障碍。这些发现为 PPARG 调节和 PPARγ 相关疾病开辟了一个未探索的场景。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号