当前位置:
X-MOL 学术
›
Nat. Commun.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Targeting SPINK1 in the damaged tumour microenvironment alleviates therapeutic resistance.
Nature Communications ( IF 14.7 ) Pub Date : 2018-10-17 , DOI: 10.1038/s41467-018-06860-4 Fei Chen 1 , Qilai Long 2 , Da Fu 3 , Dexiang Zhu 4 , Yan Ji 1 , Liu Han 1 , Boyi Zhang 1 , Qixia Xu 5 , Bingjie Liu 6 , Yan Li 1 , Shanshan Wu 1 , Chen Yang 1 , Min Qian 1 , Jianmin Xu 4 , Suling Liu 6 , Liu Cao 7 , Y Eugene Chin 8 , Eric W-F Lam 9 , Jean-Philippe Coppé 10 , Yu Sun 1, 5, 11
Nature Communications ( IF 14.7 ) Pub Date : 2018-10-17 , DOI: 10.1038/s41467-018-06860-4 Fei Chen 1 , Qilai Long 2 , Da Fu 3 , Dexiang Zhu 4 , Yan Ji 1 , Liu Han 1 , Boyi Zhang 1 , Qixia Xu 5 , Bingjie Liu 6 , Yan Li 1 , Shanshan Wu 1 , Chen Yang 1 , Min Qian 1 , Jianmin Xu 4 , Suling Liu 6 , Liu Cao 7 , Y Eugene Chin 8 , Eric W-F Lam 9 , Jean-Philippe Coppé 10 , Yu Sun 1, 5, 11
Affiliation
|
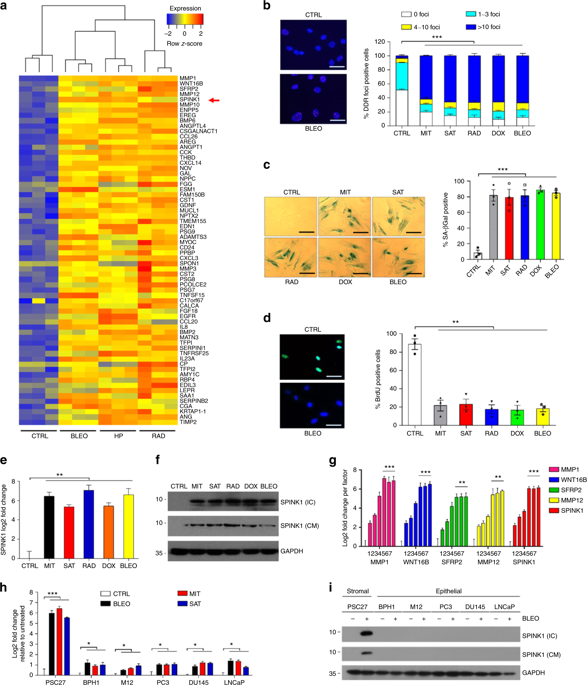
Chemotherapy and radiation not only trigger cancer cell apoptosis but also damage stromal cells in the tumour microenvironment (TME), inducing a senescence-associated secretory phenotype (SASP) characterized by chronic secretion of diverse soluble factors. Here we report serine protease inhibitor Kazal type I (SPINK1), a SASP factor produced in human stromal cells after genotoxic treatment. DNA damage causes SPINK1 expression by engaging NF-κB and C/EBP, while paracrine SPINK1 promotes cancer cell aggressiveness particularly chemoresistance. Strikingly, SPINK1 reprograms the expression profile of cancer cells, causing prominent epithelial-endothelial transition (EET), a phenotypic switch mediated by EGFR signaling but hitherto rarely reported for a SASP factor. In vivo, SPINK1 is expressed in the stroma of solid tumours and is routinely detectable in peripheral blood of cancer patients after chemotherapy. Our study substantiates SPINK1 as both a targetable SASP factor and a novel noninvasive biomarker of therapeutically damaged TME for disease control and clinical surveillance.
中文翻译:

在受损的肿瘤微环境中靶向 SPINK1 可减轻治疗耐药性。
化疗和放疗不仅会引发癌细胞凋亡,还会损害肿瘤微环境(TME)中的基质细胞,诱导以慢性分泌多种可溶性因子为特征的衰老相关分泌表型(SASP)。在这里,我们报道了丝氨酸蛋白酶抑制剂 Kazal I 型 (SPINK1),这是一种在基因毒性处理后在人类基质细胞中产生的 SASP 因子。 DNA 损伤通过与 NF-κB 和 C/EBP 结合而导致 SPINK1 表达,而旁分泌 SPINK1 会促进癌细胞的侵袭性,特别是化疗耐药性。引人注目的是,SPINK1 重新编程癌细胞的表达谱,引起显着的上皮内皮转变 (EET),这是一种由 EGFR 信号转导介导的表型转换,但迄今为止很少有关于 SASP 因子的报道。在体内,SPINK1在实体瘤的基质中表达,并且在化疗后的癌症患者的外周血中常规可检测到。我们的研究证实 SPINK1 既是一种可靶向的 SASP 因子,也是一种用于疾病控制和临床监测的治疗受损 TME 的新型非侵入性生物标志物。
更新日期:2018-10-17
中文翻译:

在受损的肿瘤微环境中靶向 SPINK1 可减轻治疗耐药性。
化疗和放疗不仅会引发癌细胞凋亡,还会损害肿瘤微环境(TME)中的基质细胞,诱导以慢性分泌多种可溶性因子为特征的衰老相关分泌表型(SASP)。在这里,我们报道了丝氨酸蛋白酶抑制剂 Kazal I 型 (SPINK1),这是一种在基因毒性处理后在人类基质细胞中产生的 SASP 因子。 DNA 损伤通过与 NF-κB 和 C/EBP 结合而导致 SPINK1 表达,而旁分泌 SPINK1 会促进癌细胞的侵袭性,特别是化疗耐药性。引人注目的是,SPINK1 重新编程癌细胞的表达谱,引起显着的上皮内皮转变 (EET),这是一种由 EGFR 信号转导介导的表型转换,但迄今为止很少有关于 SASP 因子的报道。在体内,SPINK1在实体瘤的基质中表达,并且在化疗后的癌症患者的外周血中常规可检测到。我们的研究证实 SPINK1 既是一种可靶向的 SASP 因子,也是一种用于疾病控制和临床监测的治疗受损 TME 的新型非侵入性生物标志物。































 京公网安备 11010802027423号
京公网安备 11010802027423号