当前位置:
X-MOL 学术
›
J. Am. Chem. Soc.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
完整蛋白质中 α-螺旋氢键协同性的观察
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-02-08 , DOI: 10.1021/jacs.5b13140
Jingwen Li , Yefei Wang , Jingfei Chen , Zhijun Liu 1 , Ad Bax 2 , Lishan Yao
Journal of the American Chemical Society ( IF 14.4 ) Pub Date : 2016-02-08 , DOI: 10.1021/jacs.5b13140
Jingwen Li , Yefei Wang , Jingfei Chen , Zhijun Liu 1 , Ad Bax 2 , Lishan Yao
Affiliation
|
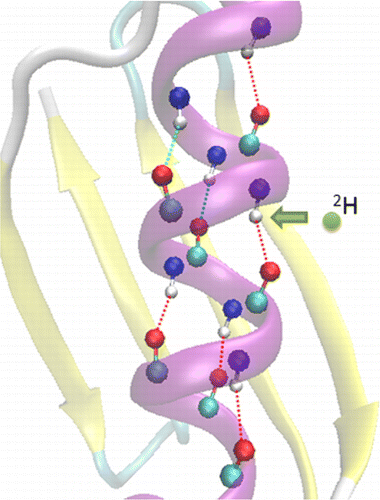
蛋白质中氢键(H-bonding)协同性的存在和程度仍然是一个基本问题,过去已对此进行了广泛研究,主要是通过对模型肽进行红外和荧光测量。我们证明,可以通过氢/氘交换核磁共振波谱研究完整蛋白质中的这种协同性。该方法基于这样的事实:主链酰胺基团中的NH被ND取代会稍微削弱NH·O=C氢键。我们的结果表明,α-螺旋中位置 i 的这种取代会影响残基 i - 3 至 i + 3 的酰胺位点的 (1)H 和 (15)N 化学位移。量子力学计算表明,在位点 i - 3、i + 1、i + 2 和 i + 3 处进行 H/D 交换时观察到,位点 i 处的 (1)H 和 (15)N 共振对应于第 i 个主链酰胺电偶极子的减少矩,这削弱了其与 α 螺旋中其他主链酰胺的氢键和长程静电相互作用。这些结果为蛋白质 α 螺旋中氢键的协同性提供了新的定量见解。

"点击查看英文标题和摘要"
更新日期:2016-02-08

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号