当前位置:
X-MOL 学术
›
Free Radical Bio. Med.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
通过与过氧化氢酶一对一连接来增强Mn超氧化物歧化酶的活性和稳定性
Free Radical Biology and Medicine ( IF 7.1 ) Pub Date : 2018-09-15 , DOI: 10.1016/j.freeradbiomed.2018.09.018 Rong Li , Xiaoqi Zhou , Dan Liu , Wei Feng

"点击查看英文标题和摘要"
更新日期:2018-09-15
Free Radical Biology and Medicine ( IF 7.1 ) Pub Date : 2018-09-15 , DOI: 10.1016/j.freeradbiomed.2018.09.018 Rong Li , Xiaoqi Zhou , Dan Liu , Wei Feng
|
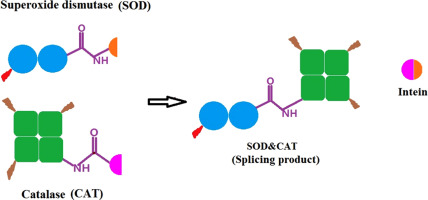
超氧化物歧化酶(SOD)使超氧化物歧化产生过氧化氢,该过氧化氢可还原为羟基自由基。在催化过程中产生的H 2 O 2可能会对SOD产生氧化损伤。过氧化氢酶(CAT)分解的过氧化氢可以帮助解决该问题。Mn超氧化物歧化酶(本文称为SOD)和CAT分别是二聚体和四聚体蛋白。在本文中,通过内含肽介导的体内亚基剪接,已将CAT亚基(CAT S)的C末端特异性地连接至具有肽键的SOD亚基(SOD S)的N末端。因此,拼接产物SOD,CAT结合了超氧阴离子(•Ø 2 -)清除能力和分解H 2 O 2的能力。圆二色性(CD)光谱证实,体内亚基剪接对酶的二级结构影响很小。荧光光谱表明,剪接产物SOD&CAT具有比SOD更高的稳定性。在剪接产物SOD&CAT中,SOD亚基与CAT亚基非常接近,从而促进了H 2 O 2在酶之间的立即转移,并使得H 2 O 2能够有效分解。SOD,CAT表现出超氧阴离子(•Ø 2 - )清除能力比SOD的46%比混合酶SOD + CAT的更高更高244%。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号