当前位置:
X-MOL 学术
›
ACS Appl. Mater. Interfaces
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
温度诱导的BSA蛋白分子变性以改善表面钝化涂层
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2018-09-04 00:00:00 , DOI: 10.1021/acsami.8b13749 Jae Hyeon Park 1 , Joshua A. Jackman 1 , Abdul Rahim Ferhan 1 , Gamaliel Junren Ma 1 , Bo Kyeong Yoon 1 , Nam-Joon Cho 1, 2
ACS Applied Materials & Interfaces ( IF 8.3 ) Pub Date : 2018-09-04 00:00:00 , DOI: 10.1021/acsami.8b13749 Jae Hyeon Park 1 , Joshua A. Jackman 1 , Abdul Rahim Ferhan 1 , Gamaliel Junren Ma 1 , Bo Kyeong Yoon 1 , Nam-Joon Cho 1, 2
Affiliation
|
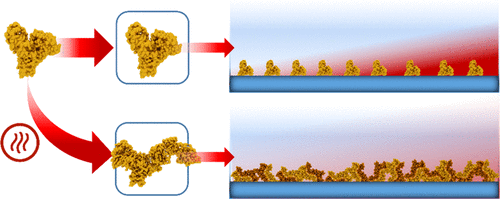
牛血清白蛋白(BSA)是最广泛用于表面钝化应用的蛋白质,尽管它与亲水性表面(如二氧化硅基材料)具有相对较弱的非粘性相互作用。在本文中,我们报告了一种简单而通用的方法来增加BSA蛋白分子吸附到二氧化硅表面上的粘性,从而使针对血清生物污染的阻断效率提高多达10倍。圆二色光谱,动态光散射和纳米颗粒跟踪分析表明,温度诱导的BSA蛋白质在本体溶液中的变性导致不可逆的展开和蛋白质寡聚,从而将粘附力弱的蛋白质单体转化为粘附力更强的寡聚形式。冷却后,经热处理的变性BSA低聚物保持稳定。室温石英微平衡耗散和局部表面等离子体共振实验表明,变性的BSA低聚物比天然BSA单体更快,更大量地吸附到二氧化硅表面。我们还确定,变性的BSA低聚物的较大的表面接触面积是导致其更具粘合性的重要因素。重要的是,变性的BSA低聚物是一种优异的钝化剂,可抑制二氧化硅表面的生物结垢,并改善Western blot应用性能。综上所述,这些发现证明了温度诱导的BSA蛋白分子变性如何能够导致用于表面钝化应用的改进的基于蛋白质的涂层。

"点击查看英文标题和摘要"
更新日期:2018-09-04

"点击查看英文标题和摘要"













































 京公网安备 11010802027423号
京公网安备 11010802027423号