当前位置:
X-MOL 学术
›
Food Res. Int.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Conjugates of α-lactalbumin, β-lactoglobulin, and lysozyme with polysaccharides: Characterization and techno-functional properties.
Food Research International ( IF 7.0 ) Pub Date : 2018-08-21 , DOI: 10.1016/j.foodres.2018.08.065
Igor José Boggione Santos 1 , Héctor Luís Hernandez Hernandez 2 , Mariana Helena Cardoso Costa 3 , José Antônio de Queiroz Lafetá 3 , Jane Sélia Dos Reis Coimbra 3
Food Research International ( IF 7.0 ) Pub Date : 2018-08-21 , DOI: 10.1016/j.foodres.2018.08.065
Igor José Boggione Santos 1 , Héctor Luís Hernandez Hernandez 2 , Mariana Helena Cardoso Costa 3 , José Antônio de Queiroz Lafetá 3 , Jane Sélia Dos Reis Coimbra 3
Affiliation
|
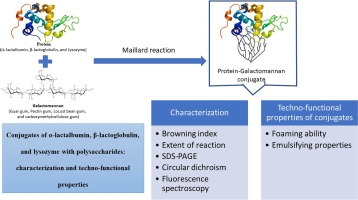
Conjugates of protein (α-lactalbumin, β-lactoglobulin, and lysozyme) with polysaccharides (guar, locust, pectin, and carboxymethilcellulose) were prepared via Maillard reaction by the dry-heating method. The conjugates were characterizated by using the browning index, extent of reaction, grafting degree, sodium dodecyl sulfate - polyacrilamide gel electrophoresis, fluorescence, and circular dichroism. The emulsifying properties and foaming ability of the formed conjugates were also evaluated. Conjugates with pectin and Lz-CMC system showed an increase in the browning index with the increase of the heating time. Circular dichroism and fluorescence data pointed out to conformational changes of proteins during glycation. The lysozyme (lz) conjugates presented the highest degree of glycation (89.1%). The α-Lactalbumin (α-la) - polysaccharides (PS) conjugates showed foam stability higher than the mixture (α-la + PS), the pure α-la, and the conjugates of β-lactoglobulin (β-lg) and lysozyme (lz) for all studied time (30, 60, and 120 min). The α-la-carboxymethylcellulose (CMC) conjugate presented the highest value of foaming stability (85.71). The pure β-lg shows greater foam stability and volume than β-lg-PS conjugates and mixture (β-lg + PS). The lz conjugates do not exihibit foam stability, except for the lz-CMC conjugate that showed stability up to 60 min. Furthermore, emulsion stability of the systems was affected by sonication time. Conjugates of α-la have greatly potencial applications as novel foaming agents in food industry.
中文翻译:

α-乳白蛋白,β-乳球蛋白和溶菌酶与多糖的结合物:表征和技术功能特性。
通过干热法通过美拉德反应制备蛋白质(α-乳白蛋白,β-乳球蛋白和溶菌酶)与多糖(瓜尔豆,刺槐,果胶和羧甲基纤维素)的结合物。通过使用褐变指数,反应程度,接枝度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,荧光和圆二色性来表征缀合物。还评估了形成的缀合物的乳化性能和起泡能力。果胶和Lz-CMC系统的共轭物显示,随着加热时间的增加,褐变指数增加。圆二色性和荧光数据指出糖基化过程中蛋白质的构象变化。溶菌酶(lz)偶联物的糖基化程度最高(89.1%)。α-乳清蛋白(α-la)-多糖(PS)偶联物显示的泡沫稳定性高于混合物(α-la+ PS),纯α-la以及β-乳球蛋白(β-lg)和溶菌酶的偶联物(lz)适用于所有研究时间(30、60和120分钟)。α-la-羧甲基纤维素(CMC)共轭物表现出最高的发泡稳定性(85.71)。纯的β-Ig表现出比β-Ig-PS共轭物和混合物(β-Ig+ PS)更大的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。在所有研究时间内(30、60和120分钟),β-乳球蛋白(β-lg)和溶菌酶(lz)的结合物。α-la-羧甲基纤维素(CMC)共轭物表现出最高的发泡稳定性(85.71)。与β-lg-PS共轭物和混合物(β-lg+ PS)相比,纯净的β-lg显示出更高的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。在所有研究时间内(30、60和120分钟),β-乳球蛋白(β-lg)和溶菌酶(lz)的结合物。α-la-羧甲基纤维素(CMC)共轭物表现出最高的发泡稳定性(85.71)。与β-lg-PS共轭物和混合物(β-lg+ PS)相比,纯净的β-lg显示出更高的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。纯的β-Ig表现出比β-Ig-PS共轭物和混合物(β-Ig+ PS)更大的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。纯的β-Ig表现出比β-Ig-PS共轭物和混合物(β-Ig+ PS)更大的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。
更新日期:2018-08-21
中文翻译:

α-乳白蛋白,β-乳球蛋白和溶菌酶与多糖的结合物:表征和技术功能特性。
通过干热法通过美拉德反应制备蛋白质(α-乳白蛋白,β-乳球蛋白和溶菌酶)与多糖(瓜尔豆,刺槐,果胶和羧甲基纤维素)的结合物。通过使用褐变指数,反应程度,接枝度,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,荧光和圆二色性来表征缀合物。还评估了形成的缀合物的乳化性能和起泡能力。果胶和Lz-CMC系统的共轭物显示,随着加热时间的增加,褐变指数增加。圆二色性和荧光数据指出糖基化过程中蛋白质的构象变化。溶菌酶(lz)偶联物的糖基化程度最高(89.1%)。α-乳清蛋白(α-la)-多糖(PS)偶联物显示的泡沫稳定性高于混合物(α-la+ PS),纯α-la以及β-乳球蛋白(β-lg)和溶菌酶的偶联物(lz)适用于所有研究时间(30、60和120分钟)。α-la-羧甲基纤维素(CMC)共轭物表现出最高的发泡稳定性(85.71)。纯的β-Ig表现出比β-Ig-PS共轭物和混合物(β-Ig+ PS)更大的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。在所有研究时间内(30、60和120分钟),β-乳球蛋白(β-lg)和溶菌酶(lz)的结合物。α-la-羧甲基纤维素(CMC)共轭物表现出最高的发泡稳定性(85.71)。与β-lg-PS共轭物和混合物(β-lg+ PS)相比,纯净的β-lg显示出更高的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。在所有研究时间内(30、60和120分钟),β-乳球蛋白(β-lg)和溶菌酶(lz)的结合物。α-la-羧甲基纤维素(CMC)共轭物表现出最高的发泡稳定性(85.71)。与β-lg-PS共轭物和混合物(β-lg+ PS)相比,纯净的β-lg显示出更高的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。纯的β-Ig表现出比β-Ig-PS共轭物和混合物(β-Ig+ PS)更大的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。纯的β-Ig表现出比β-Ig-PS共轭物和混合物(β-Ig+ PS)更大的泡沫稳定性和体积。Iz共轭物没有表现出泡沫稳定性,除了Iz-CMC共轭物在60分钟内显示出稳定性。此外,系统的乳液稳定性受超声处理时间的影响。α-la的缀合物作为食品工业中的新型发泡剂具有巨大的潜力。

































 京公网安备 11010802027423号
京公网安备 11010802027423号