当前位置:
X-MOL 学术
›
ACS Catal.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
过氧化物酶中非典型的Mn(II)氧化位点的描述
ACS Catalysis ( IF 11.3 ) Pub Date : 2018-07-31 00:00:00 , DOI: 10.1021/acscatal.8b02306
Elena Fernández-Fueyo 1 , Irene Davó-Siguero 1 , David Almendral 1 , Dolores Linde 1 , Maria Camilla Baratto 2, 3 , Rebecca Pogni 2, 3 , Antonio Romero 1 , Victor Guallar 4, 5 , Angel T. Martínez 1
ACS Catalysis ( IF 11.3 ) Pub Date : 2018-07-31 00:00:00 , DOI: 10.1021/acscatal.8b02306
Elena Fernández-Fueyo 1 , Irene Davó-Siguero 1 , David Almendral 1 , Dolores Linde 1 , Maria Camilla Baratto 2, 3 , Rebecca Pogni 2, 3 , Antonio Romero 1 , Victor Guallar 4, 5 , Angel T. Martínez 1
Affiliation
|
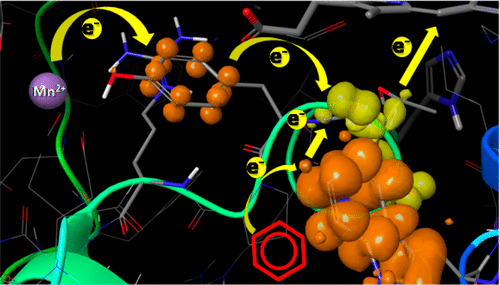
平菇(Pos DyP4)中的染料脱色过氧化物酶(DyP)在H 2 O 2存在下催化Mn 2+氧化为Mn 3+,其效率与众所周知的锰过氧化物酶和通用的过氧化物酶相似从这个和其他白腐真菌。Pos DyP4作为活性酶已在大肠杆菌中过表达,其晶体结构已以1.56Å的分辨率解析。使用PELE软件,解析电子顺磁共振和定点诱变对解析结构上的基质扩散模拟进行组合,从而鉴定出Mn 2+中涉及的残基氧化。Pos DyP4中的氧化位点与上述其他Mn氧化过氧化物酶中的保守位点不同,它包含位于蛋白质表面的四个酸性残基(三个天冬氨酸和一个谷氨酸)。此外,由于Mn 2+离子不与丙酸血红素直接接触,因此酪氨酸残基参与电子转移至辅因子,是金属离子Pos DyP4氧化的唯一必需的单独残基。四个酸性残基在不同程度上促进了Mn 2+的结合,谷氨酸也参与了电子向关键酪氨酸的初始转移,这被k cat减少了50倍以上所证实。除去其侧链羧基后。第二个电子转移途径在Pos DyP4中起作用,用于从表面色氨酸开始氧化芳香族化合物和染料,正如其他真菌和原核DyPs所报道的那样,并与Mn 2+氧化途径的最后部分相连。潜在参与催化作用的色氨酸和酪氨酸自由基分别通过天然酶及其无色氨酸变异体的电子顺磁共振检测到。

"点击查看英文标题和摘要"
更新日期:2018-07-31

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号