当前位置:
X-MOL 学术
›
ACS Biomater. Sci. Eng.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
丝素蛋白的结构及其粘合性能之间的相互作用
ACS Biomaterials Science & Engineering ( IF 5.4 ) Pub Date : 2018-07-20 00:00:00 , DOI: 10.1021/acsbiomaterials.8b00544 Erik R. Johnston 1 , Yu Miyagi 2 , Jo-Ann Chuah 2 , Keiji Numata 2 , Monica A. Serban 1, 3
ACS Biomaterials Science & Engineering ( IF 5.4 ) Pub Date : 2018-07-20 00:00:00 , DOI: 10.1021/acsbiomaterials.8b00544 Erik R. Johnston 1 , Yu Miyagi 2 , Jo-Ann Chuah 2 , Keiji Numata 2 , Monica A. Serban 1, 3
Affiliation
|
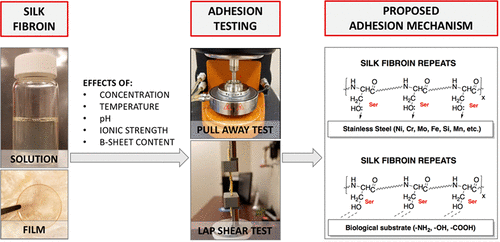
家蚕衍生的丝素蛋白(SF)是在许多生物医学应用中使用的特性良好的蛋白质。在结构上,SF由通过单二硫键连接的重链和轻链组成。HC序列被组织成12个晶域,并散布着无定形区域,这些区域可以在无规卷曲/α-螺旋和β-折叠构型之间转换,从而赋予丝绸其标志性性质。据报道,SF具有胶粘性能,并有望开发医用胶粘剂。然而,这些相互作用的机理以及SF的结构和粘附之间的相互作用尚不清楚。在这种情况下,本研究研究了物理参数(即浓度,温度,pH和离子强度)和蛋白质结构变化对粘附的影响。我们的结果表明,具有能够协调(固定)键或氢键形成功能的氨基酸侧链(例如丝氨酸和酪氨酸的侧链)可能是SF与给定底物粘附的重要决定因素。另外,数据表明,参与β-折叠形成的纤维蛋白氨基酸在蛋白质与底物的粘附中也很重要。

"点击查看英文标题和摘要"
更新日期:2018-07-20

"点击查看英文标题和摘要"















































 京公网安备 11010802027423号
京公网安备 11010802027423号