JAMA Oncology ( IF 22.5 ) Pub Date : 2018-09-01 , DOI: 10.1001/jamaoncol.2018.1812
Virginia F. Borges 1 , Cristiano Ferrario 2 , Nathalie Aucoin 3 , Carla Falkson 4 , Qamar Khan 5 , Ian Krop 6 , Stephen Welch 7 , Alison Conlin 8 , Jorge Chaves 9 , Philippe L. Bedard 10 , Marc Chamberlain 11 , Todd Gray 11 , Alex Vo 11 , Erika Hamilton 12
|
重视 患者的曲妥珠单抗,帕妥珠单抗和ADO-曲妥珠单抗emtansine(T-DM1)治疗后疾病进展的治疗选择是有限的。图卡替尼是一种口服有效的人表皮生长因子受体2(HER2)特异性酪氨酸激酶抑制剂(TKI),被开发为ERBB2 / HER2阳性乳腺癌的新型治疗方法。
目的 确定图卡替尼联合T-DM1治疗ERBB2 / HER2阳性转移性乳腺癌伴和不伴脑转移的最大耐受剂量。
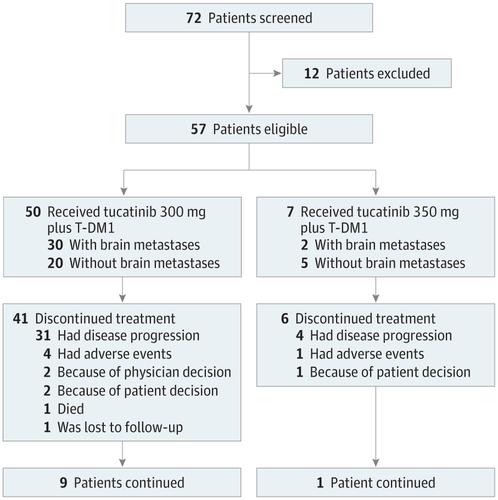
设计,背景和参与者 在此1b期开放式,多中心,临床试验中,2014年1月22日至2015年6月22日之间招募的57名参与者年龄在18岁或以上,患有ERBB2 / HER2阳性转移性乳腺癌。以前用曲妥珠单抗和紫杉烷治疗过。分析了2018年1月至2018年3月之间的数据。
干预措施 每天口服两次300 mg或350 mg图卡替尼,持续21天,而每21天静脉注射T-DM1 3.6 mg / kg。
主要结果和措施 使用RECIST 1.1每2个周期评估安全评估,药代动力学和反应,共6个周期,然后每3个周期评估一次。
结果 治疗了57位T-DM1初治患者(中位[IQR] 51 [44.0-63.0]岁),他们接受了2种早期HER2治疗(范围为1-3)的中位数。图卡替尼的最大耐受剂量确定为每天300 mg,每天两次,每天两次,剂量限制毒性反应为350 mg。药代动力学分析表明与T-DM1没有药物相互作用。在不考虑因果关系的情况下以最大耐受剂量治疗的50例患者中出现的不良事件包括恶心(36例; 72%),腹泻(30例; 60%),疲劳(28例; 56%),鼻22(22例; 44) %),头痛(22例; 44%),呕吐(21例; 42%),便秘(21例; 42%)和食欲不振(20例; 40%);大多数不良事件为1级或2级。
结论与相关性 在这项研究中,图卡替尼联合T-DM1似乎具有可接受的毒性,并且在经过大量预处理的ERBB2 / HER2阳性转移性乳腺癌患者中,无论有无脑转移,均显示出初步的抗肿瘤活性。
试验注册 ClinicalTrials.gov标识符:NCT01983501

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号