当前位置:
X-MOL 学术
›
ACS Chem. Neurosci.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Tau蛋白单体的小分子靶向性的结构基础。
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2018-07-16 , DOI: 10.1021/acschemneuro.8b00182 Róbert Kiss 1 , Georgina Csizmadia 1 , Katalin Solti 1 , Attila Keresztes 1 , Max Zhu 2 , Marcus Pickhardt 3, 4 , Eckhard Mandelkow 3, 4 , Gergely Tóth 1, 2
ACS Chemical Neuroscience ( IF 4.1 ) Pub Date : 2018-07-16 , DOI: 10.1021/acschemneuro.8b00182 Róbert Kiss 1 , Georgina Csizmadia 1 , Katalin Solti 1 , Attila Keresztes 1 , Max Zhu 2 , Marcus Pickhardt 3, 4 , Eckhard Mandelkow 3, 4 , Gergely Tóth 1, 2
Affiliation
|
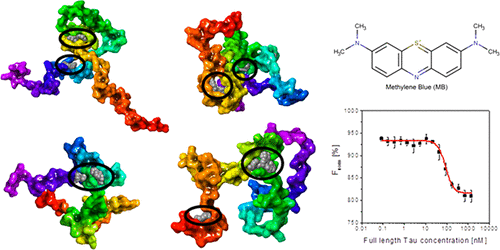
由于小分子的异质构象集合,小分子对内在无序蛋白(IDP)的治疗靶向一直是一个挑战。减轻IDP聚集的潜在治疗策略是通过小分子结合将其保持在其天然单体状态。这项研究调查了天然单体Tau的小分子可药物性的结构基础,该天然Tau的聚集与陶氏病(如阿尔茨海默氏病)的发作有关。最初,分析了两个较短的Tau构建体K18的可用单体构象集成体(也称为Tau4RD),发现这两个集成体之间存在显着的结构差异,而在单体Tau集成体上发现的热点和小分子结合位点数量与第三级相似。折叠大小相似的蛋白质。值得注意的是,与其他区域相比,Tau的一些关键原纤维形成序列区域(V306-K311,V275-K280)以更高的频率参与了热点形成。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。与其他地区相比,V275-K280)参与热点形成的频率更高。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。与其他地区相比,V275-K280)参与热点形成的频率更高。作为小分子与单体Tau结合的一个例子,已显示亚甲基蓝(MB)以高亲和力(分别为Kd = 125.8 nM和86.6 nM)选择性结合到单体K18和全长Tau,结合方式涉及Cys291和以前报道过在MB存在下被氧化的Cys322。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。结果表明,亚甲基蓝(MB)以高亲和力(分别为Kd分别为125.8 nM和86.6 nM)与Cys291和Cys322的结合模式高选择性地结合到单体K18和全长Tau上,先前报道过在存在Cys291和Cys322的情况下会被氧化。 MB。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响蛋白质彼此之间以及与其他蛋白质相互作用的方式。结果表明,亚甲基蓝(MB)以高亲和力(分别为Kd分别为125.8 nM和86.6 nM)与Cys291和Cys322的结合模式高选择性地结合到单体K18和全长Tau上,先前报道过在存在Cys291和Cys322的情况下会被氧化。 MB。总体而言,我们的结果提供了基于结构的证据,表明Tau可以成为小分子的可行药物靶标,并表明特定的小分子可能能够与单体Tau结合,并影响该蛋白质彼此之间以及与其他蛋白质相互作用的方式。

"点击查看英文标题和摘要"
更新日期:2018-06-26

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号