当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
EGF通过其SH2和SH3结构域调节Tks4与Src的相互作用
Biochemistry ( IF 2.9 ) Pub Date : 2018-06-21 00:00:00 , DOI: 10.1021/acs.biochem.8b00084
Metta Dülk 1 , Bálint Szeder 1 , Gábor Glatz 2 , Balázs L. Merő 1 , Kitti Koprivanacz 1 , Gyöngyi Kudlik 1 , Virág Vas 1 , Szabolcs Sipeki 3 , Anna Cserkaszky 1 , László Radnai 1 , László Buday 1, 3
Biochemistry ( IF 2.9 ) Pub Date : 2018-06-21 00:00:00 , DOI: 10.1021/acs.biochem.8b00084
Metta Dülk 1 , Bálint Szeder 1 , Gábor Glatz 2 , Balázs L. Merő 1 , Kitti Koprivanacz 1 , Gyöngyi Kudlik 1 , Virág Vas 1 , Szabolcs Sipeki 3 , Anna Cserkaszky 1 , László Radnai 1 , László Buday 1, 3
Affiliation
|
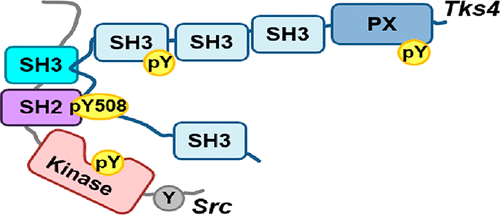
非受体酪氨酸激酶Src是表皮生长因子(EGF)信号传导途径的重要组成部分。我们的小组最近表明,Frank-ter Haar综合征蛋白Tks4(具有四个Src同源性3结构域的酪氨酸激酶底物)也参与EGF信号传导。在这里,我们证明Tks4和Src直接彼此结合,并阐明这种复合物形成的分子机制的细节。GST下拉和荧光偏振测定的结果表明,Tks4中富含脯氨酸的SH3结合基序(PSRPLPDAP,残基466–474)和相邻的含磷酸酪氨酸的SH2结合基序(pYEEI,残基508–511)均与Tks4的产生有关Src绑定。这些基序分别与Src的SH3和SH2域相互作用,从而导致结合强度的协同增强和高度稳定,“双向”类型的交互。与这些结果一致,我们发现Src与Tks4的结合是永久的,并且该复合物在活细胞中持续至少3 h。我们得出结论,Tks4与Src的相互作用可能会导致激酶处于其主动构象的长期稳定状态,从而导致EGF刺激后Src活性延长。

"点击查看英文标题和摘要"
更新日期:2018-06-21

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号