Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Control of cardiac jelly dynamics by NOTCH1 and NRG1 defines the building plan for trabeculation
Nature ( IF 50.5 ) Pub Date : 2018-05-01 , DOI: 10.1038/s41586-018-0110-6 Gonzalo Del Monte-Nieto 1, 2 , Mirana Ramialison 3 , Arne A S Adam 1 , Bingruo Wu 4 , Alla Aharonov 5 , Gabriele D'Uva 5 , Lauren M Bourke 6, 7 , Mara E Pitulescu 8, 9 , Hanying Chen 10 , José Luis de la Pompa 11, 12 , Weinian Shou 10 , Ralf H Adams 8, 9 , Sarah K Harten 6, 7 , Eldad Tzahor 5 , Bin Zhou 4 , Richard P Harvey 1, 2, 13
Nature ( IF 50.5 ) Pub Date : 2018-05-01 , DOI: 10.1038/s41586-018-0110-6 Gonzalo Del Monte-Nieto 1, 2 , Mirana Ramialison 3 , Arne A S Adam 1 , Bingruo Wu 4 , Alla Aharonov 5 , Gabriele D'Uva 5 , Lauren M Bourke 6, 7 , Mara E Pitulescu 8, 9 , Hanying Chen 10 , José Luis de la Pompa 11, 12 , Weinian Shou 10 , Ralf H Adams 8, 9 , Sarah K Harten 6, 7 , Eldad Tzahor 5 , Bin Zhou 4 , Richard P Harvey 1, 2, 13
Affiliation
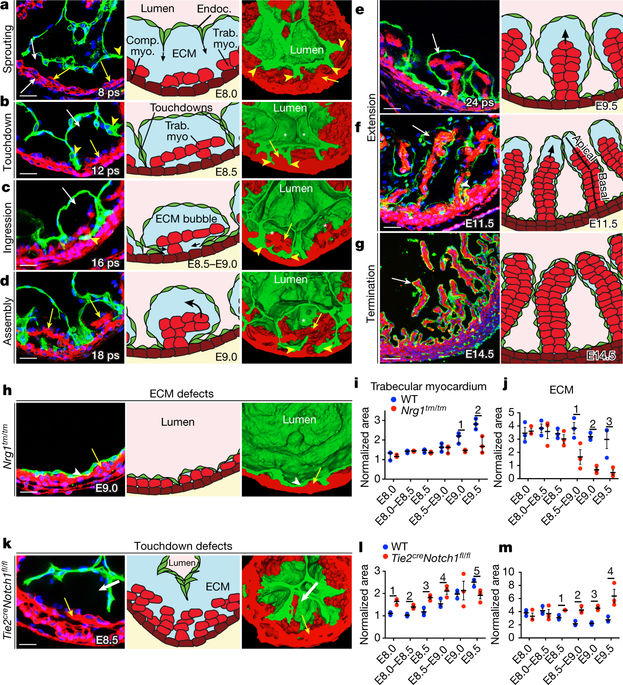
|
In vertebrate hearts, the ventricular trabecular myocardium develops as a sponge-like network of cardiomyocytes that is critical for contraction and conduction, ventricular septation, papillary muscle formation and wall thickening through the process of compaction1. Defective trabeculation leads to embryonic lethality2–4 or non-compaction cardiomyopathy (NCC)5. There are divergent views on when and how trabeculation is initiated in different species. In zebrafish, trabecular cardiomyocytes extrude from compact myocardium6, whereas in chicks, chamber wall thickening occurs before overt trabeculation7. In mice, the onset of trabeculation has not been described, but is proposed to begin at embryonic day 9.0, when cardiomyocytes form radially oriented ribs2. Endocardium–myocardium communication is essential for trabeculation, and numerous signalling pathways have been identified, including Notch2,8 and Neuregulin (NRG)4. Late disruption of the Notch pathway causes NCC5. Whereas it has been shown that mutations in the extracellular matrix (ECM) genes Has2 and Vcan prevent the formation of trabeculae in mice9,10 and the matrix metalloprotease ADAMTS1 promotes trabecular termination3, the pathways involved in ECM dynamics and the molecular regulation of trabeculation during its early phases remain unexplored. Here we present a model of trabeculation in mice that integrates dynamic endocardial and myocardial cell behaviours and ECM remodelling, and reveal new epistatic relationships between the involved signalling pathways. NOTCH1 signalling promotes ECM degradation during the formation of endocardial projections that are critical for individualization of trabecular units, whereas NRG1 promotes myocardial ECM synthesis, which is necessary for trabecular rearrangement and growth. These systems interconnect through NRG1 control of Vegfa, but act antagonistically to establish trabecular architecture. These insights enabled the prediction of persistent ECM and cardiomyocyte growth in a mouse NCC model, providing new insights into the pathophysiology of congenital heart disease.A new model of cardiac trabeculation in mice is presented in which NOTCH1 and NRG1 have opposing roles in extracellular matrix degradation and synthesis that are essential for defining trabecular architecture.
中文翻译:

NOTCH1 和 NRG1 对心脏果冻动力学的控制定义了小梁的构建计划
在脊椎动物心脏中,心室小梁心肌发育为海绵状心肌细胞网络,通过压实过程对收缩和传导、心室分隔、乳头肌形成和壁增厚至关重要。有缺陷的小梁导致胚胎致死率 2–4 或非致密性心肌病 (NCC)5。关于不同物种何时以及如何开始小梁形成有不同的看法。在斑马鱼中,小梁心肌细胞从致密的心肌中挤出 6,而在小鸡中,室壁增厚发生在明显的小梁形成之前 7。在小鼠中,小梁形成的发生尚未被描述,但建议在胚胎第 9.0 天开始,此时心肌细胞形成径向定向的肋骨 2。心内膜-心肌通讯对于小梁形成至关重要,并且已经确定了许多信号通路,包括 Notch2,8 和 Neuregulin (NRG)4。Notch 通路的晚期破坏导致 NCC5。虽然已经表明细胞外基质 (ECM) 基因 Has2 和 Vcan 中的突变阻止了小鼠小梁的形成 9, 10 并且基质金属蛋白酶 ADAMTS1 促进小梁终止 3,但涉及 ECM 动力学的途径和小梁在其形成过程中的分子调控早期阶段仍未探索。在这里,我们提出了一种小鼠小梁模型,该模型整合了动态心内膜和心肌细胞行为以及 ECM 重塑,并揭示了相关信号通路之间的新上位关系。NOTCH1 信号在心内膜投射形成过程中促进 ECM 降解,这对小梁单位的个体化至关重要,而 NRG1 促进心肌 ECM 合成,这是小梁重排和生长所必需的。这些系统通过 Vegfa 的 NRG1 控制相互连接,但相互对抗以建立小梁结构。这些见解能够预测小鼠 NCC 模型中持续的 ECM 和心肌细胞生长,为先天性心脏病的病理生理学提供新的见解。 提出了一种新的小鼠心脏小梁模型,其中 NOTCH1 和 NRG1 在细胞外基质降解中具有相反的作用和合成对于定义小梁结构至关重要。
更新日期:2018-05-01
中文翻译:

NOTCH1 和 NRG1 对心脏果冻动力学的控制定义了小梁的构建计划
在脊椎动物心脏中,心室小梁心肌发育为海绵状心肌细胞网络,通过压实过程对收缩和传导、心室分隔、乳头肌形成和壁增厚至关重要。有缺陷的小梁导致胚胎致死率 2–4 或非致密性心肌病 (NCC)5。关于不同物种何时以及如何开始小梁形成有不同的看法。在斑马鱼中,小梁心肌细胞从致密的心肌中挤出 6,而在小鸡中,室壁增厚发生在明显的小梁形成之前 7。在小鼠中,小梁形成的发生尚未被描述,但建议在胚胎第 9.0 天开始,此时心肌细胞形成径向定向的肋骨 2。心内膜-心肌通讯对于小梁形成至关重要,并且已经确定了许多信号通路,包括 Notch2,8 和 Neuregulin (NRG)4。Notch 通路的晚期破坏导致 NCC5。虽然已经表明细胞外基质 (ECM) 基因 Has2 和 Vcan 中的突变阻止了小鼠小梁的形成 9, 10 并且基质金属蛋白酶 ADAMTS1 促进小梁终止 3,但涉及 ECM 动力学的途径和小梁在其形成过程中的分子调控早期阶段仍未探索。在这里,我们提出了一种小鼠小梁模型,该模型整合了动态心内膜和心肌细胞行为以及 ECM 重塑,并揭示了相关信号通路之间的新上位关系。NOTCH1 信号在心内膜投射形成过程中促进 ECM 降解,这对小梁单位的个体化至关重要,而 NRG1 促进心肌 ECM 合成,这是小梁重排和生长所必需的。这些系统通过 Vegfa 的 NRG1 控制相互连接,但相互对抗以建立小梁结构。这些见解能够预测小鼠 NCC 模型中持续的 ECM 和心肌细胞生长,为先天性心脏病的病理生理学提供新的见解。 提出了一种新的小鼠心脏小梁模型,其中 NOTCH1 和 NRG1 在细胞外基质降解中具有相反的作用和合成对于定义小梁结构至关重要。































 京公网安备 11010802027423号
京公网安备 11010802027423号