Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
GPCR介导的抑制蛋白激活的分子机制
Nature ( IF 50.5 ) Pub Date : 2018-05-01 , DOI: 10.1038/s41586-018-0077-3 Naomi R Latorraca 1, 2, 3, 4 , Jason K Wang 2 , Brian Bauer 5 , Raphael J L Townshend 2 , Scott A Hollingsworth 1, 2, 3 , Julia E Olivieri 4 , H Eric Xu 6, 7 , Martha E Sommer 5 , Ron O Dror 1, 2, 3, 4
Affiliation
|
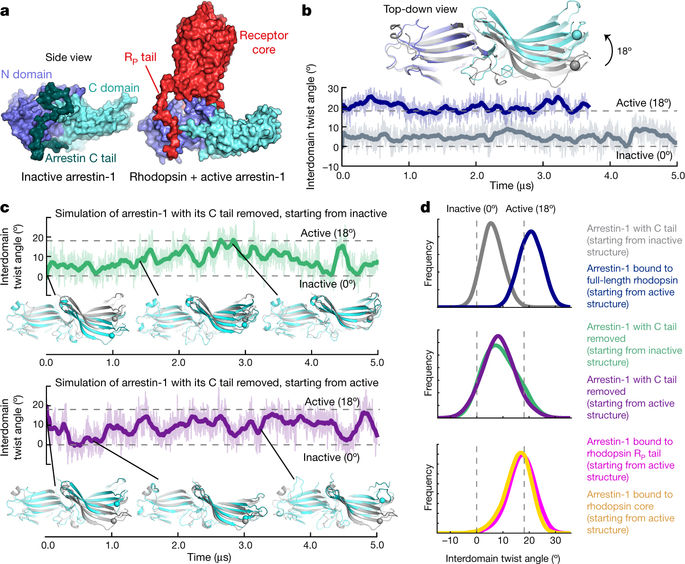
尽管人们对发现导致 G 蛋白偶联受体 (GPCR) 选择性刺激或阻断抑制蛋白信号传导的药物抱有浓厚兴趣,但受体介导的抑制蛋白激活的结构机制仍不清楚1,2。在这里,我们通过广泛的视紫红质抑制蛋白的原子级模拟揭示了这种机制。我们发现受体的跨膜核心和细胞质尾部(结合视紫红质抑制蛋白的不同表面)可以各自独立地刺激视紫红质抑制蛋白激活。我们使用定点荧光光谱证实了受体核心的这种意想不到的作用,以及视紫红质抑制蛋白这些遥远表面之间的变构耦合。受体核心对视紫红质抑制蛋白构象的影响主要是通过受体的细胞内环与视紫红质抑制蛋白体的相互作用介导的,而不是在受体结合时观察到的明显的指环重排。在没有受体的情况下,视紫红质抑制蛋白在其自身的 C 末端尾部脱离时经常采取活性构象,这可以解释为什么某些视紫红质抑制蛋白在受体解离后很长时间仍保持活性。我们的结果表明,不同的受体结合模式可以激活视紫红质抑制蛋白,为设计功能选择性(“偏向”)GPCR 靶向配体提供了结构基础,对视紫红质抑制蛋白信号传导产生所需的影响。分子动力学模拟和定点荧光光谱显示G蛋白偶联受体的跨膜核心和胞质尾独立并协同激活视紫红质抑制蛋白。

"点击查看英文标题和摘要"















































 京公网安备 11010802027423号
京公网安备 11010802027423号