当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Functional Studies on Oligotropha carboxidovorans Molybdenum–Copper CO Dehydrogenase Produced in Escherichia coli
Biochemistry ( IF 2.9 ) Pub Date : 2018-04-20 00:00:00 , DOI: 10.1021/acs.biochem.8b00128 Paul Kaufmann 1 , Benjamin R. Duffus 1 , Christian Teutloff 2 , Silke Leimkühler 1
Biochemistry ( IF 2.9 ) Pub Date : 2018-04-20 00:00:00 , DOI: 10.1021/acs.biochem.8b00128 Paul Kaufmann 1 , Benjamin R. Duffus 1 , Christian Teutloff 2 , Silke Leimkühler 1
Affiliation
|
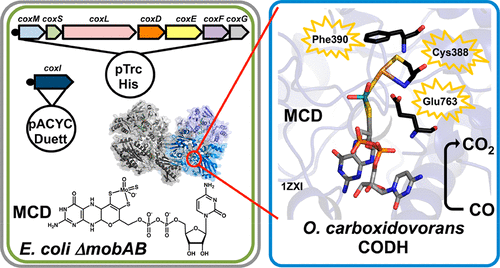
The Mo/Cu-dependent CO dehydrogenase (CODH) from Oligotropha carboxidovorans is an enzyme that is able to catalyze both the oxidation of CO to CO2 and the oxidation of H2 to protons and electrons. Despite the close to atomic resolution structure (1.1 Å), significant uncertainties have remained with regard to the reaction mechanism of substrate oxidation at the unique Mo/Cu center, as well as the nature of intermediates formed during the catalytic cycle. So far, the investigation of the role of amino acids at the active site was hampered by the lack of a suitable expression system that allowed for detailed site-directed mutagenesis studies at the active site. Here, we report on the establishment of a functional heterologous expression system of O. carboxidovorans CODH in Escherichia coli. We characterize the purified enzyme in detail by a combination of kinetic and spectroscopic studies and show that it was purified in a form with characteristics comparable to those of the native enzyme purified from O. carboxidovorans. With this expression system in hand, we were for the first time able to generate active-site variants of this enzyme. Our work presents the basis for more detailed studies of the reaction mechanism for CO and H2 oxidation of Mo/Cu-dependent CODHs in the future.
中文翻译:

大肠杆菌中产生的麦加寡糖碳氧化钼钼-铜CO脱氢酶的功能研究
来自Oligotropha carboxidovorans的Mo / Cu依赖性CO脱氢酶(CODH)是一种能够催化CO氧化为CO 2以及H 2氧化为质子和电子的酶。尽管具有接近原子分辨率的结构(1.1Å),但在独特的Mo / Cu中心的底物氧化反应机理以及催化循环过程中形成的中间体的性质方面,仍存在很大的不确定性。迄今为止,由于缺乏合适的表达系统,无法进行活性位点的详细的定点诱变研究,因此妨碍了对氨基酸在活性位点上的作用的研究。在这里,我们报告功能性异源表达系统的建立O.carboxidovorans CODH在大肠杆菌中。我们通过动力学和光谱学研究的结合对纯化的酶进行了详细的表征,表明纯化的酶具有与从O. carboxidovorans纯化的天然酶相当的特性。有了这个表达系统,我们第一次能够产生这种酶的活性位点变体。我们的工作为今后进一步研究Mo / Cu依赖性CODH的CO和H 2氧化反应机理提供了基础。
更新日期:2018-04-20
中文翻译:

大肠杆菌中产生的麦加寡糖碳氧化钼钼-铜CO脱氢酶的功能研究
来自Oligotropha carboxidovorans的Mo / Cu依赖性CO脱氢酶(CODH)是一种能够催化CO氧化为CO 2以及H 2氧化为质子和电子的酶。尽管具有接近原子分辨率的结构(1.1Å),但在独特的Mo / Cu中心的底物氧化反应机理以及催化循环过程中形成的中间体的性质方面,仍存在很大的不确定性。迄今为止,由于缺乏合适的表达系统,无法进行活性位点的详细的定点诱变研究,因此妨碍了对氨基酸在活性位点上的作用的研究。在这里,我们报告功能性异源表达系统的建立O.carboxidovorans CODH在大肠杆菌中。我们通过动力学和光谱学研究的结合对纯化的酶进行了详细的表征,表明纯化的酶具有与从O. carboxidovorans纯化的天然酶相当的特性。有了这个表达系统,我们第一次能够产生这种酶的活性位点变体。我们的工作为今后进一步研究Mo / Cu依赖性CODH的CO和H 2氧化反应机理提供了基础。

































 京公网安备 11010802027423号
京公网安备 11010802027423号