Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation.
Cell ( IF 45.5 ) Pub Date : 2018-Apr-19 , DOI: 10.1016/j.cell.2018.03.004 Mario Hofweber 1 , Saskia Hutten 2 , Benjamin Bourgeois 3 , Emil Spreitzer 3 , Annika Niedner-Boblenz 4 , Martina Schifferer 5 , Marc-David Ruepp 6 , Mikael Simons 5 , Dierk Niessing 7 , Tobias Madl 3 , Dorothee Dormann 8
Cell ( IF 45.5 ) Pub Date : 2018-Apr-19 , DOI: 10.1016/j.cell.2018.03.004 Mario Hofweber 1 , Saskia Hutten 2 , Benjamin Bourgeois 3 , Emil Spreitzer 3 , Annika Niedner-Boblenz 4 , Martina Schifferer 5 , Marc-David Ruepp 6 , Mikael Simons 5 , Dierk Niessing 7 , Tobias Madl 3 , Dorothee Dormann 8
Affiliation
|
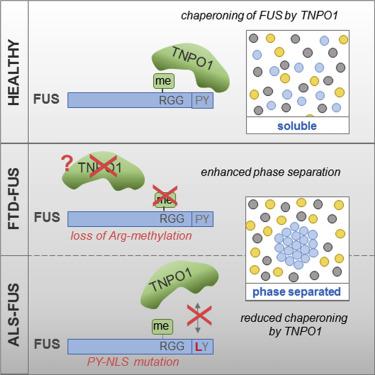
Cytoplasmic FUS aggregates are a pathological hallmark in a subset of patients with frontotemporal dementia (FTD) or amyotrophic lateral sclerosis (ALS). A key step that is disrupted in these patients is nuclear import of FUS mediated by the import receptor Transportin/Karyopherin-β2. In ALS-FUS patients, this is caused by mutations in the nuclear localization signal (NLS) of FUS that weaken Transportin binding. In FTD-FUS patients, Transportin is aggregated, and post-translational arginine methylation, which regulates the FUS-Transportin interaction, is lost. Here, we show that Transportin and arginine methylation have a crucial function beyond nuclear import-namely to suppress RGG/RG-driven phase separation and stress granule association of FUS. ALS-associated FUS-NLS mutations weaken the chaperone activity of Transportin and loss of FUS arginine methylation, as seen in FTD-FUS, promote phase separation, and stress granule partitioning of FUS. Our findings reveal two regulatory mechanisms of liquid-phase homeostasis that are disrupted in FUS-associated neurodegeneration.
中文翻译:

FUS 的相分离被其核输入受体和精氨酸甲基化抑制。
细胞质 FUS 聚集体是额颞叶痴呆 (FTD) 或肌萎缩侧索硬化症 (ALS) 患者子集的病理标志。在这些患者中被破坏的一个关键步骤是由输入受体转运蛋白/核转运蛋白-β2 介导的 FUS 的核输入。在 ALS-FUS 患者中,这是由 FUS 的核定位信号 (NLS) 突变导致转运蛋白结合减弱。在 FTD-FUS 患者中,转运蛋白聚集,调节 FUS-转运蛋白相互作用的翻译后精氨酸甲基化丢失。在这里,我们表明转运蛋白和精氨酸甲基化具有超越核输入的关键功能,即抑制 RGG/RG 驱动的相分离和 FUS 的应力颗粒结合。ALS 相关的 FUS-NLS 突变削弱了转运蛋白的伴侣活性和 FUS 精氨酸甲基化的丧失,如 FTD-FUS 中所见,促进 FUS 的相分离和应力颗粒分配。我们的研究结果揭示了在 FUS 相关的神经变性中被破坏的两种液相稳态调节机制。
更新日期:2018-04-26
中文翻译:

FUS 的相分离被其核输入受体和精氨酸甲基化抑制。
细胞质 FUS 聚集体是额颞叶痴呆 (FTD) 或肌萎缩侧索硬化症 (ALS) 患者子集的病理标志。在这些患者中被破坏的一个关键步骤是由输入受体转运蛋白/核转运蛋白-β2 介导的 FUS 的核输入。在 ALS-FUS 患者中,这是由 FUS 的核定位信号 (NLS) 突变导致转运蛋白结合减弱。在 FTD-FUS 患者中,转运蛋白聚集,调节 FUS-转运蛋白相互作用的翻译后精氨酸甲基化丢失。在这里,我们表明转运蛋白和精氨酸甲基化具有超越核输入的关键功能,即抑制 RGG/RG 驱动的相分离和 FUS 的应力颗粒结合。ALS 相关的 FUS-NLS 突变削弱了转运蛋白的伴侣活性和 FUS 精氨酸甲基化的丧失,如 FTD-FUS 中所见,促进 FUS 的相分离和应力颗粒分配。我们的研究结果揭示了在 FUS 相关的神经变性中被破坏的两种液相稳态调节机制。

































 京公网安备 11010802027423号
京公网安备 11010802027423号