Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
神经肽 Y Y1 受体配体结合模式的结构基础
Nature ( IF 50.5 ) Pub Date : 2018-04-01 , DOI: 10.1038/s41586-018-0046-x
Zhenlin Yang 1, 2 , Shuo Han 1, 3 , Max Keller 4 , Anette Kaiser 5 , Brian J Bender 6 , Mathias Bosse 7 , Kerstin Burkert 5 , Lisa M Kögler 5 , David Wifling 4 , Guenther Bernhardt 4 , Nicole Plank 4 , Timo Littmann 4 , Peter Schmidt 7 , Cuiying Yi 1 , Beibei Li 1, 8 , Sheng Ye 3 , Rongguang Zhang 3, 9 , Bo Xu 10 , Dan Larhammar 10 , Raymond C Stevens 11, 12 , Daniel Huster 7 , Jens Meiler 6, 13 , Qiang Zhao 1, 2, 8, 14 , Annette G Beck-Sickinger 5 , Armin Buschauer 4 , Beili Wu 1, 8, 12, 14
Nature ( IF 50.5 ) Pub Date : 2018-04-01 , DOI: 10.1038/s41586-018-0046-x
Zhenlin Yang 1, 2 , Shuo Han 1, 3 , Max Keller 4 , Anette Kaiser 5 , Brian J Bender 6 , Mathias Bosse 7 , Kerstin Burkert 5 , Lisa M Kögler 5 , David Wifling 4 , Guenther Bernhardt 4 , Nicole Plank 4 , Timo Littmann 4 , Peter Schmidt 7 , Cuiying Yi 1 , Beibei Li 1, 8 , Sheng Ye 3 , Rongguang Zhang 3, 9 , Bo Xu 10 , Dan Larhammar 10 , Raymond C Stevens 11, 12 , Daniel Huster 7 , Jens Meiler 6, 13 , Qiang Zhao 1, 2, 8, 14 , Annette G Beck-Sickinger 5 , Armin Buschauer 4 , Beili Wu 1, 8, 12, 14
Affiliation
|
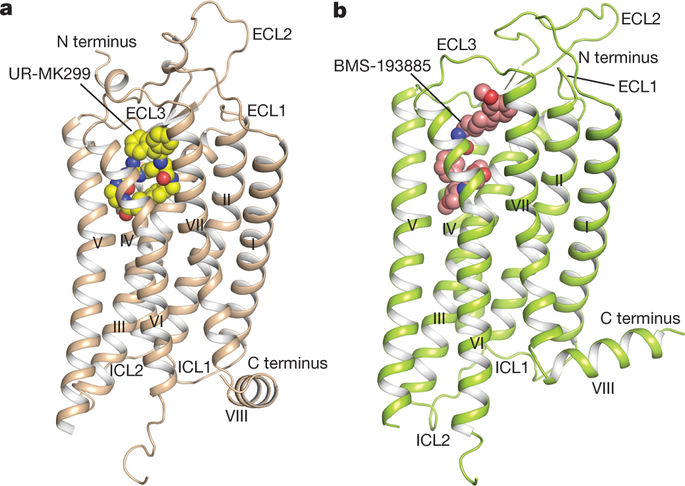
神经肽 Y (NPY) 受体属于 G 蛋白偶联受体超家族,在食物摄入、焦虑和癌症生物学中具有重要作用 1,2。NPY-Y 受体系统已成为最复杂的网络之一,具有三种肽配体(NPY、肽 YY 和胰多肽)与大多数哺乳动物中的四种受体(即 Y1、Y2、Y4 和 Y5 受体)结合,具有不同的亲和力和选择性3。NPY 是最强大的食物摄入兴奋剂,这种作用主要由 Y1 受体 (Y1R)4 介导。许多肽和小分子化合物已被表征为 Y1R 拮抗剂,并已显示出治疗肥胖 4、肿瘤 1 和骨质流失 5 的临床潜力。然而,它们的临床应用受到低效力和选择性的阻碍,脑渗透能力差或缺乏口服生物利用度6。在这里,我们分别报告了与两种选择性拮抗剂 UR-MK299 和 BMS-193885 结合的人类 Y1R 的晶体结构,分辨率分别为 2.7 和 3.0 Å。结合诱变研究的结构揭示了 Y1R 与几种结构不同的拮抗剂的结合模式和配体选择性的决定因素。内源性激动剂 NPY 的 Y1R 结构和分子对接,连同核磁共振、光交联和功能研究,提供了对激动剂结合行为的深入了解,据我们所知,这是第一次确定其 N 的相互作用末端与受体。这些对 Y1R 的见解可以实现针对 NPY 受体的基于结构的药物发现。

"点击查看英文标题和摘要"
更新日期:2018-04-01

"点击查看英文标题和摘要"




































 京公网安备 11010802027423号
京公网安备 11010802027423号