Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
A mechanism of glucose tolerance and stimulation of GH1 β-glucosidases.
Scientific Reports ( IF 3.8 ) Pub Date : 2015-Nov-25 , DOI: 10.1038/srep17296 Yang Yang , Xinxin Zhang , Qiang Yin , Wei Fang , Zemin Fang , Xiaotang Wang , Xuecheng Zhang , Yazhong Xiao
Scientific Reports ( IF 3.8 ) Pub Date : 2015-Nov-25 , DOI: 10.1038/srep17296 Yang Yang , Xinxin Zhang , Qiang Yin , Wei Fang , Zemin Fang , Xiaotang Wang , Xuecheng Zhang , Yazhong Xiao
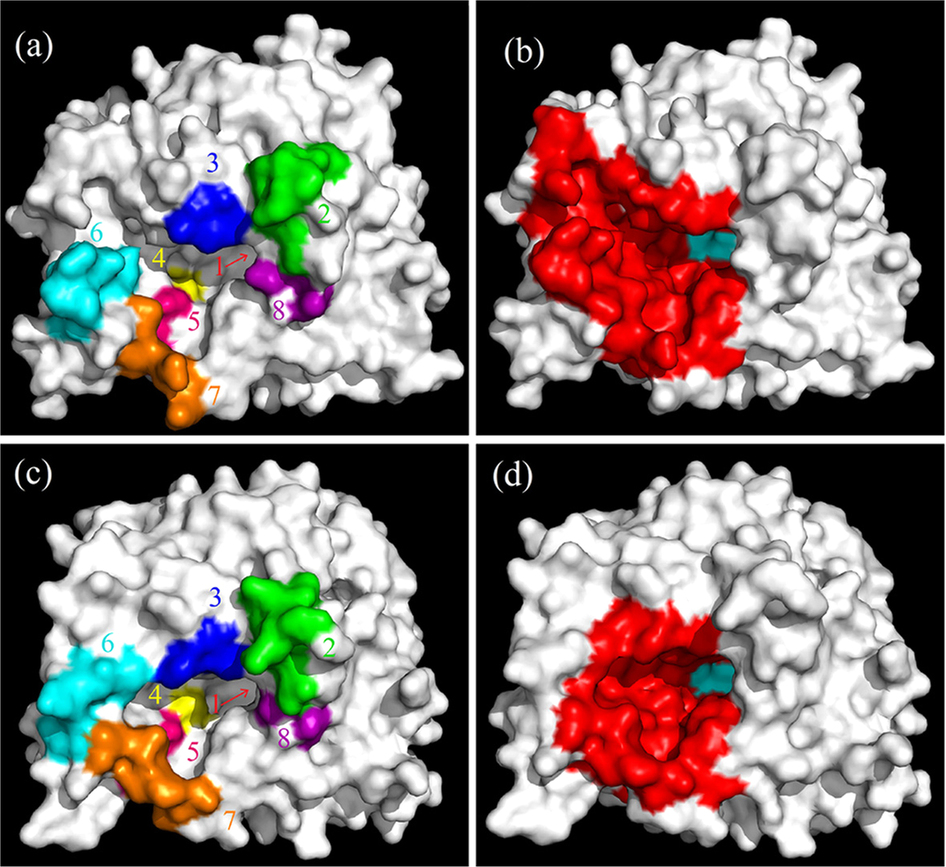
|
β-Glucosidases are enzymes that hydrolyze β-glycosidic bonds to release non-reducing terminal glucosyl residues from glycosides and oligosaccharides, and thus have significant application potential in industries. However, most β-glucosidases are feedback inhibited by the glucose product, which restricts their application. Remarkably, some β-glucosidases of the glycoside hydrolase (GH) 1 family are tolerant to or even stimulated by glucose. Elucidation of the mechanisms of glucose tolerance and stimulation of the GH1 β-glucosidases will be crucial to improve their application through enzyme engineering. In this study, by comparing the primary and tertiary structures of two GH1 β-glucosidases with distinct glucose dependence, some putative glucose-dependence relevant sites were mutated to investigate their exact roles. Both biochemical and structural characterization of the mutants suggested that some sites at the entrance and middle of the substrate channel regulate the effects of glucose, and the relative binding affinity/preference of these sites to glucose modulates the glucose dependence. A mechanism was therefore proposed to interpret the glucose dependence of GH1 β-glucosidases. This research provides fresh insight into our current understanding of the properties and mechanisms of GH1 β-glycosidases and related enzymes that modulate their activity via feedback control mechanism.
中文翻译:

葡萄糖耐量和GH1β-葡萄糖苷酶刺激的机制。
β-葡糖苷酶是水解β-糖苷键以从糖苷和寡糖释放非还原性末端葡糖基残基的酶,因此在工业中具有巨大的应用潜力。然而,大多数β-葡萄糖苷酶被葡萄糖产物抑制反馈,这限制了它们的应用。值得注意的是,糖苷水解酶(GH)1家族的某些β-葡萄糖苷酶可耐受葡萄糖甚至被葡萄糖刺激。阐明葡萄糖耐量的机制和GH1β-葡萄糖苷酶的刺激对于通过酶工程改善其应用至关重要。在这项研究中,通过比较两个具有明显葡萄糖依赖性的GH1β-葡萄糖苷酶的一级和三级结构,对一些假定的葡萄糖依赖性相关位点进行了突变,以研究它们的确切作用。突变体的生物化学和结构表征都表明底物通道入口和中间的某些位点调节葡萄糖的作用,并且这些位点对葡萄糖的相对结合亲和力/偏好性调节了葡萄糖依赖性。因此,提出了一种机制来解释GH1β-葡萄糖苷酶的葡萄糖依赖性。这项研究为我们目前对GH1β-糖苷酶及相关酶的性质和机制的理解提供了新的见解,而GH1β-糖苷酶和相关酶通过反馈控制机制调节其活性。因此,提出了一种机制来解释GH1β-葡萄糖苷酶的葡萄糖依赖性。这项研究为我们目前对GH1β-糖苷酶及相关酶的性质和机制的理解提供了新的见解,而GH1β-糖苷酶和相关酶通过反馈控制机制调节其活性。因此,提出了一种机制来解释GH1β-葡萄糖苷酶的葡萄糖依赖性。这项研究为我们目前对GH1β-糖苷酶及相关酶的性质和机制的理解提供了新的见解,而这些酶通过反馈控制机制调节其活性。
更新日期:2015-11-27
中文翻译:

葡萄糖耐量和GH1β-葡萄糖苷酶刺激的机制。
β-葡糖苷酶是水解β-糖苷键以从糖苷和寡糖释放非还原性末端葡糖基残基的酶,因此在工业中具有巨大的应用潜力。然而,大多数β-葡萄糖苷酶被葡萄糖产物抑制反馈,这限制了它们的应用。值得注意的是,糖苷水解酶(GH)1家族的某些β-葡萄糖苷酶可耐受葡萄糖甚至被葡萄糖刺激。阐明葡萄糖耐量的机制和GH1β-葡萄糖苷酶的刺激对于通过酶工程改善其应用至关重要。在这项研究中,通过比较两个具有明显葡萄糖依赖性的GH1β-葡萄糖苷酶的一级和三级结构,对一些假定的葡萄糖依赖性相关位点进行了突变,以研究它们的确切作用。突变体的生物化学和结构表征都表明底物通道入口和中间的某些位点调节葡萄糖的作用,并且这些位点对葡萄糖的相对结合亲和力/偏好性调节了葡萄糖依赖性。因此,提出了一种机制来解释GH1β-葡萄糖苷酶的葡萄糖依赖性。这项研究为我们目前对GH1β-糖苷酶及相关酶的性质和机制的理解提供了新的见解,而GH1β-糖苷酶和相关酶通过反馈控制机制调节其活性。因此,提出了一种机制来解释GH1β-葡萄糖苷酶的葡萄糖依赖性。这项研究为我们目前对GH1β-糖苷酶及相关酶的性质和机制的理解提供了新的见解,而GH1β-糖苷酶和相关酶通过反馈控制机制调节其活性。因此,提出了一种机制来解释GH1β-葡萄糖苷酶的葡萄糖依赖性。这项研究为我们目前对GH1β-糖苷酶及相关酶的性质和机制的理解提供了新的见解,而这些酶通过反馈控制机制调节其活性。































 京公网安备 11010802027423号
京公网安备 11010802027423号