当前位置:
X-MOL 学术
›
Cell Metab.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Rewiring of Glutamine Metabolism Is a Bioenergetic Adaptation of Human Cells with Mitochondrial DNA Mutations.
Cell Metabolism ( IF 27.7 ) Pub Date : 2018-May-01 , DOI: 10.1016/j.cmet.2018.03.002 Qiuying Chen 1 , Kathryne Kirk 2 , Yevgeniya I Shurubor 2 , Dazhi Zhao 2 , Andrea J Arreguin 2 , Ifrah Shahi 2 , Federica Valsecchi 2 , Guido Primiano 3 , Elizabeth L Calder 4 , Valerio Carelli 5 , Travis T Denton 6 , M Flint Beal 2 , Steven S Gross 1 , Giovanni Manfredi 2 , Marilena D'Aurelio 2
Cell Metabolism ( IF 27.7 ) Pub Date : 2018-May-01 , DOI: 10.1016/j.cmet.2018.03.002 Qiuying Chen 1 , Kathryne Kirk 2 , Yevgeniya I Shurubor 2 , Dazhi Zhao 2 , Andrea J Arreguin 2 , Ifrah Shahi 2 , Federica Valsecchi 2 , Guido Primiano 3 , Elizabeth L Calder 4 , Valerio Carelli 5 , Travis T Denton 6 , M Flint Beal 2 , Steven S Gross 1 , Giovanni Manfredi 2 , Marilena D'Aurelio 2
Affiliation
|
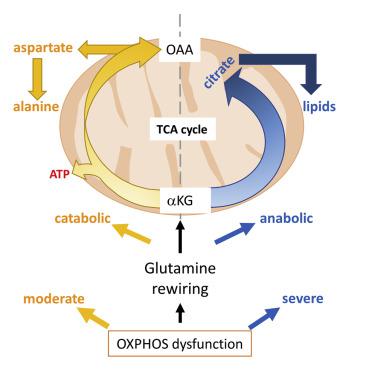
Using molecular, biochemical, and untargeted stable isotope tracing approaches, we identify a previously unappreciated glutamine-derived α-ketoglutarate (αKG) energy-generating anaplerotic flux to be critical in mitochondrial DNA (mtDNA) mutant cells that harbor human disease-associated oxidative phosphorylation defects. Stimulating this flux with αKG supplementation enables the survival of diverse mtDNA mutant cells under otherwise lethal obligatory oxidative conditions. Strikingly, we demonstrate that when residual mitochondrial respiration in mtDNA mutant cells exceeds 45% of control levels, αKG oxidative flux prevails over reductive carboxylation. Furthermore, in a mouse model of mitochondrial myopathy, we show that increased oxidative αKG flux in muscle arises from enhanced alanine synthesis and release into blood, concomitant with accelerated amino acid catabolism from protein breakdown. Importantly, in this mouse model of mitochondriopathy, muscle amino acid imbalance is normalized by αKG supplementation. Taken together, our findings provide a rationale for αKG supplementation as a therapeutic strategy for mitochondrial myopathies.
中文翻译:

谷氨酰胺代谢的重新布线是人类细胞与线粒体 DNA 突变的生物能量适应。
使用分子、生化和非靶向稳定同位素示踪方法,我们确定了以前未被重视的谷氨酰胺衍生的 α-酮戊二酸 (αKG) 产生能量的厌氧通量在线粒体 DNA (mtDNA) 突变细胞中至关重要,这些细胞携带人类疾病相关的氧化磷酸化缺陷。用 αKG 补充剂刺激这种通量,使不同的 mtDNA 突变细胞能够在其他致命的强制性氧化条件下存活。引人注目的是,我们证明当 mtDNA 突变细胞中残留的线粒体呼吸超过对照水平的 45% 时,αKG 氧化通量优于还原羧化。此外,在线粒体肌病的小鼠模型中,我们表明肌肉中氧化 αKG 通量的增加是由于丙氨酸合成和释放到血液中的能力增强引起的,伴随着蛋白质分解引起的氨基酸分解代谢加速。重要的是,在这种线粒体病小鼠模型中,肌肉氨基酸失衡通过补充 αKG 而正常化。综上所述,我们的研究结果为补充 αKG 作为线粒体肌病的治疗策略提供了基本原理。
更新日期:2018-04-27
中文翻译:

谷氨酰胺代谢的重新布线是人类细胞与线粒体 DNA 突变的生物能量适应。
使用分子、生化和非靶向稳定同位素示踪方法,我们确定了以前未被重视的谷氨酰胺衍生的 α-酮戊二酸 (αKG) 产生能量的厌氧通量在线粒体 DNA (mtDNA) 突变细胞中至关重要,这些细胞携带人类疾病相关的氧化磷酸化缺陷。用 αKG 补充剂刺激这种通量,使不同的 mtDNA 突变细胞能够在其他致命的强制性氧化条件下存活。引人注目的是,我们证明当 mtDNA 突变细胞中残留的线粒体呼吸超过对照水平的 45% 时,αKG 氧化通量优于还原羧化。此外,在线粒体肌病的小鼠模型中,我们表明肌肉中氧化 αKG 通量的增加是由于丙氨酸合成和释放到血液中的能力增强引起的,伴随着蛋白质分解引起的氨基酸分解代谢加速。重要的是,在这种线粒体病小鼠模型中,肌肉氨基酸失衡通过补充 αKG 而正常化。综上所述,我们的研究结果为补充 αKG 作为线粒体肌病的治疗策略提供了基本原理。































 京公网安备 11010802027423号
京公网安备 11010802027423号