Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
DNA Repair Network Analysis Reveals Shieldin as a Key Regulator of NHEJ and PARP Inhibitor Sensitivity.
Cell ( IF 45.5 ) Pub Date : 2018-May-03 , DOI: 10.1016/j.cell.2018.03.050 Rajat Gupta 1 , Kumar Somyajit 2 , Takeo Narita 1 , Elina Maskey 1 , Andre Stanlie 3 , Magdalena Kremer 4 , Dimitris Typas 2 , Michael Lammers 5 , Niels Mailand 2 , Andre Nussenzweig 3 , Jiri Lukas 2 , Chunaram Choudhary 6
Cell ( IF 45.5 ) Pub Date : 2018-May-03 , DOI: 10.1016/j.cell.2018.03.050 Rajat Gupta 1 , Kumar Somyajit 2 , Takeo Narita 1 , Elina Maskey 1 , Andre Stanlie 3 , Magdalena Kremer 4 , Dimitris Typas 2 , Michael Lammers 5 , Niels Mailand 2 , Andre Nussenzweig 3 , Jiri Lukas 2 , Chunaram Choudhary 6
Affiliation
|
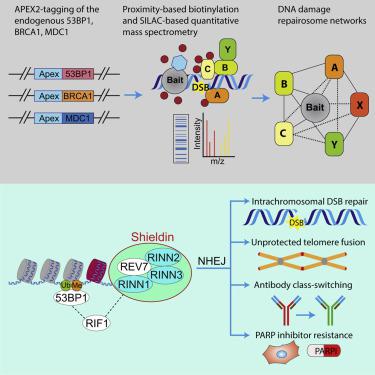
Repair of damaged DNA is essential for maintaining genome integrity and for preventing genome-instability-associated diseases, such as cancer. By combining proximity labeling with quantitative mass spectrometry, we generated high-resolution interaction neighborhood maps of the endogenously expressed DNA repair factors 53BP1, BRCA1, and MDC1. Our spatially resolved interaction maps reveal rich network intricacies, identify shared and bait-specific interaction modules, and implicate previously concealed regulators in this process. We identified a novel vertebrate-specific protein complex, shieldin, comprising REV7 plus three previously uncharacterized proteins, RINN1 (CTC-534A2.2), RINN2 (FAM35A), and RINN3 (C20ORF196). Recruitment of shieldin to DSBs, via the ATM-RNF8-RNF168-53BP1-RIF1 axis, promotes NHEJ-dependent repair of intrachromosomal breaks, immunoglobulin class-switch recombination (CSR), and fusion of unprotected telomeres. Shieldin functions as a downstream effector of 53BP1-RIF1 in restraining DNA end resection and in sensitizing BRCA1-deficient cells to PARP inhibitors. These findings have implications for understanding cancer-associated PARPi resistance and the evolution of antibody CSR in higher vertebrates.
中文翻译:

DNA 修复网络分析表明 Shieldin 是 NHEJ 和 PARP 抑制剂敏感性的关键调节剂。
修复受损 DNA 对于维持基因组完整性和预防与基因组不稳定相关的疾病(例如癌症)至关重要。通过将邻近标记与定量质谱相结合,我们生成了内源表达的 DNA 修复因子 53BP1、BRCA1 和 MDC1 的高分辨率相互作用邻域图。我们的空间解析交互图揭示了丰富的网络复杂性,识别共享和特定诱饵的交互模块,并在这个过程中暗示了先前隐藏的监管者。我们鉴定了一种新型脊椎动物特异性蛋白复合物,shieldin,包含 REV7 和三个以前未表征的蛋白 RINN1 (CTC-534A2.2)、RINN2 (FAM35A) 和 RINN3 (C20ORF196)。通过 ATM-RNF8-RNF168-53BP1-RIF1 轴将屏蔽蛋白招募到 DSB,促进 NHEJ 依赖性染色体内断裂修复、免疫球蛋白类别转换重组 (CSR) 和未受保护端粒的融合。 Shieldin 作为 53BP1-RIF1 的下游效应子发挥作用,抑制 DNA 末端切除并使 BRCA1 缺陷细胞对 PARP 抑制剂敏感。这些发现对于理解癌症相关的 PARPi 耐药性以及高等脊椎动物中抗体 CSR 的进化具有重要意义。
更新日期:2018-04-26
中文翻译:

DNA 修复网络分析表明 Shieldin 是 NHEJ 和 PARP 抑制剂敏感性的关键调节剂。
修复受损 DNA 对于维持基因组完整性和预防与基因组不稳定相关的疾病(例如癌症)至关重要。通过将邻近标记与定量质谱相结合,我们生成了内源表达的 DNA 修复因子 53BP1、BRCA1 和 MDC1 的高分辨率相互作用邻域图。我们的空间解析交互图揭示了丰富的网络复杂性,识别共享和特定诱饵的交互模块,并在这个过程中暗示了先前隐藏的监管者。我们鉴定了一种新型脊椎动物特异性蛋白复合物,shieldin,包含 REV7 和三个以前未表征的蛋白 RINN1 (CTC-534A2.2)、RINN2 (FAM35A) 和 RINN3 (C20ORF196)。通过 ATM-RNF8-RNF168-53BP1-RIF1 轴将屏蔽蛋白招募到 DSB,促进 NHEJ 依赖性染色体内断裂修复、免疫球蛋白类别转换重组 (CSR) 和未受保护端粒的融合。 Shieldin 作为 53BP1-RIF1 的下游效应子发挥作用,抑制 DNA 末端切除并使 BRCA1 缺陷细胞对 PARP 抑制剂敏感。这些发现对于理解癌症相关的 PARPi 耐药性以及高等脊椎动物中抗体 CSR 的进化具有重要意义。































 京公网安备 11010802027423号
京公网安备 11010802027423号