当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
丙酮酸脱氢酶复合体的E2内核的原子结构。
Biochemistry ( IF 2.9 ) Pub Date : 2018-04-02 00:00:00 , DOI: 10.1021/acs.biochem.8b00357 Jiansen Jiang 1, 2 , Flavius L. Baiesc 1 , Yasuaki Hiromasa 3, 4 , Xuekui Yu 1, 2 , Wong Hoi Hui 2 , Xinghong Dai 1, 2 , Thomas E. Roche 4 , Z. Hong Zhou 1, 2
Biochemistry ( IF 2.9 ) Pub Date : 2018-04-02 00:00:00 , DOI: 10.1021/acs.biochem.8b00357 Jiansen Jiang 1, 2 , Flavius L. Baiesc 1 , Yasuaki Hiromasa 3, 4 , Xuekui Yu 1, 2 , Wong Hoi Hui 2 , Xinghong Dai 1, 2 , Thomas E. Roche 4 , Z. Hong Zhou 1, 2
Affiliation
|
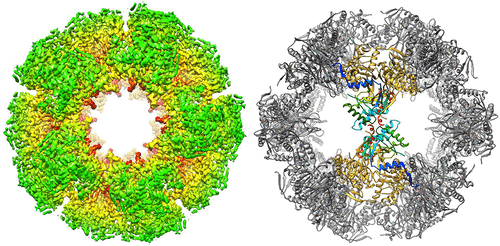
丙酮酸脱氢酶复合物(PDC)是一种大型的多酶复合物,可催化丙酮酸不可逆地转化为乙酰辅酶A,同时降低NAD +。在哺乳动物的PDC中,与低水平的PDC不同,二氢脂酰乙酰基转移酶(E2; PDC中的E2p)和二氢脂酰胺脱氢酶结合蛋白(E3BP)结合形成复合物,该复合物在催化的组织,调控和整合中起着核心作用PDC的反应。但是,哺乳动物E2p / E3BP异源复合物的原子结构和组织是未知的。在这里,我们报告由人E2p的C末端内核/催化(IC)域形成的重组十二面体核心的结构,该结构由冷冻电子显微镜(cryoEM)确定为3.1Å分辨率。人E2p IC域的N末端片段和其他四个表面积的结构与其他E2晶体结构存在显着差异,这可能与哺乳动物中E3BP的整合有关。这种结构还使我们能够获得E3BP的高度同源IC结构域的同源性模型。人E2p或E3BP与十二面体中相邻IC域的相互作用的分析为E2p / E3BP异质复合物的组织提供了新见解,并暗示了E3BP对哺乳动物PDC催化的潜在贡献。

"点击查看英文标题和摘要"
更新日期:2018-04-02

"点击查看英文标题和摘要"




















































 京公网安备 11010802027423号
京公网安备 11010802027423号