当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
酯水解酶中多个活性位点的合理工程
Biochemistry ( IF 2.9 ) Pub Date : 2018-03-30 00:00:00 , DOI: 10.1021/acs.biochem.8b00274
Gerard Santiago 1 , Mónica Martínez-Martínez 2 , Sandra Alonso 2 , Rafael Bargiela 2 , Cristina Coscolín 2 , Peter N. Golyshin , Víctor Guallar 1, 3 , Manuel Ferrer 2
Biochemistry ( IF 2.9 ) Pub Date : 2018-03-30 00:00:00 , DOI: 10.1021/acs.biochem.8b00274
Gerard Santiago 1 , Mónica Martínez-Martínez 2 , Sandra Alonso 2 , Rafael Bargiela 2 , Cristina Coscolín 2 , Peter N. Golyshin , Víctor Guallar 1, 3 , Manuel Ferrer 2
Affiliation
|
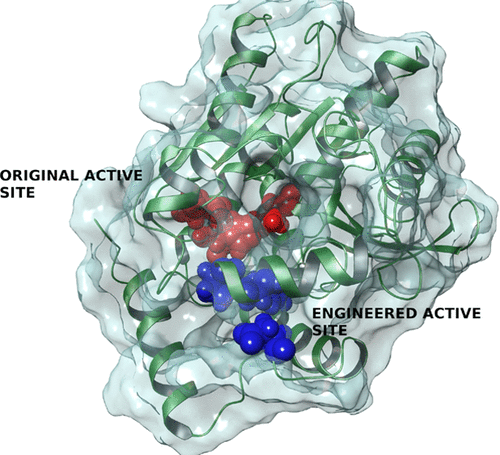
广泛报道了改变酶促均相催化剂中活性位点性质的影响。然而,仍未探索增加这种位点数目的可能性,如在非均相催化材料中通常所做的那样,特别是因为那些位点必须以特定构型容纳适当的残基。通过使用丝氨酸酯水解酶作为靶酶研究了这种可能性。通过使用可映射配体扩散和结合的蛋白质能量景观探索软件,我们发现了一个潜在的结合口袋,能够容纳额外的催化三元组和氧阴离子空穴接触。通过引入两个突变,该结合口袋成为催化位点。其底物特异性,底物偏爱,由于活性位点结构的不同,其催化活性与野生型酯水解酶和其他水解酶的天然位点不同。已证明将结合袋转变成额外的催化活性位点是创建具有两个功能性反应基团的丝氨酸酯水解酶的成功方法。我们的结果说明了现代建模技术的准确性和可预测性,为单一酶中存在不同催化环境带来了新的催化机会。

"点击查看英文标题和摘要"
更新日期:2018-03-30

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号