当前位置:
X-MOL 学术
›
PLOS Genet.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
HAT和HDAC在双链断裂位点通过人RAD52的乙酰化在同源重组中的新功能
PLOS Genetics ( IF 4.0 ) Pub Date : 2018-03-28 , DOI: 10.1371/journal.pgen.1007277 Takeshi Yasuda , Wataru Kagawa , Tomoo Ogi , Takamitsu A. Kato , Takehiro Suzuki , Naoshi Dohmae , Kazuya Takizawa , Yuka Nakazawa , Matthew D. Genet , Mika Saotome , Michio Hama , Teruaki Konishi , Nakako Izumi Nakajima , Masaharu Hazawa , Masanori Tomita , Manabu Koike , Katsuko Noshiro , Kenichi Tomiyama , Chizuka Obara , Takaya Gotoh , Ayako Ui , Akira Fujimori , Fumiaki Nakayama , Fumio Hanaoka , Kaoru Sugasawa , Ryuichi Okayasu , Penny A. Jeggo , Katsushi Tajima

"点击查看英文标题和摘要"
更新日期:2018-03-31
PLOS Genetics ( IF 4.0 ) Pub Date : 2018-03-28 , DOI: 10.1371/journal.pgen.1007277 Takeshi Yasuda , Wataru Kagawa , Tomoo Ogi , Takamitsu A. Kato , Takehiro Suzuki , Naoshi Dohmae , Kazuya Takizawa , Yuka Nakazawa , Matthew D. Genet , Mika Saotome , Michio Hama , Teruaki Konishi , Nakako Izumi Nakajima , Masaharu Hazawa , Masanori Tomita , Manabu Koike , Katsuko Noshiro , Kenichi Tomiyama , Chizuka Obara , Takaya Gotoh , Ayako Ui , Akira Fujimori , Fumiaki Nakayama , Fumio Hanaoka , Kaoru Sugasawa , Ryuichi Okayasu , Penny A. Jeggo , Katsushi Tajima
|
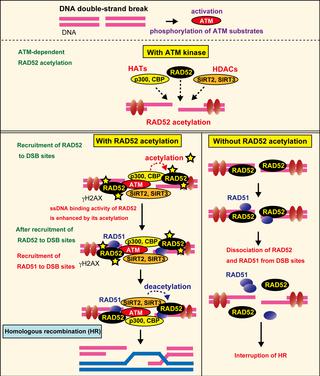
p300和CBP组蛋白乙酰基转移酶被募集到DNA双链断裂(DSB)位点,在那里它们诱导组蛋白乙酰化,从而影响染色质结构和DNA修复过程。尚不清楚在DSB位点的p300 / CBP是否也乙酰化非组蛋白蛋白,以及它们的乙酰化如何影响DSB修复。在这里,我们显示p300 / CBP乙酰化RAD52(一种人类同源重组(HR)DNA修复蛋白)在DSB位点。体外使用乙酰化的RAD52,我们通过质谱分析鉴定了RAD52中的13个潜在的乙酰化位点。免疫荧光显微镜分析表明,DSBs位点的RAD52乙酰化被SIRT2和SIRT3介导的脱乙酰基作用所抵消,未乙酰化的RAD52最初在DSB位点上积累,但过早地从它们上解离。在没有RAD52乙酰化的情况下,在HR中起核心作用的RAD51也会过早地从DSB位点解离,因此会损害HR。此外,通过siRNA或抑制剂处理对共济失调性毛细血管扩张突变(ATM)蛋白的抑制作用表明,通过在RAD52,p300 / CBP,SIRT2和SIRT3基因上形成RAD52,DSB位点RAD52的乙酰化依赖于ATM蛋白激酶活性。 DSB网站。

"点击查看英文标题和摘要"































 京公网安备 11010802027423号
京公网安备 11010802027423号