当前位置:
X-MOL 学术
›
J. Proteome Res.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
PPARα Is Necessary for Radiation-Induced Activation of Noncanonical TGFβ Signaling in the Heart
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2018-03-23 00:00:00 , DOI: 10.1021/acs.jproteome.8b00001 Vikram Subramanian , Sabine Borchard , Omid Azimzadeh , Wolfgang Sievert 1 , Juliane Merl-Pham , Mariateresa Mancuso 2 , Emanuela Pasquali 2 , Gabriele Multhoff 1 , Bastian Popper 3 , Hans Zischka , Michael J. Atkinson , Soile Tapio
Journal of Proteome Research ( IF 3.8 ) Pub Date : 2018-03-23 00:00:00 , DOI: 10.1021/acs.jproteome.8b00001 Vikram Subramanian , Sabine Borchard , Omid Azimzadeh , Wolfgang Sievert 1 , Juliane Merl-Pham , Mariateresa Mancuso 2 , Emanuela Pasquali 2 , Gabriele Multhoff 1 , Bastian Popper 3 , Hans Zischka , Michael J. Atkinson , Soile Tapio
Affiliation
|
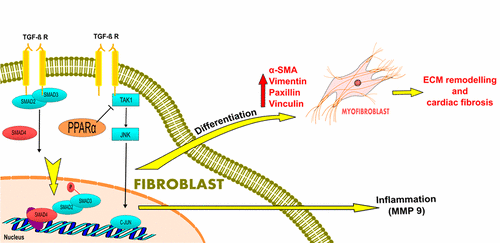
High-dose ionizing radiation is known to induce adverse effects such as inflammation and fibrosis in the heart. Transcriptional regulators PPARα and TGFβ are known to be involved in this radiation response. PPARα, an anti-inflammatory transcription factor controlling cardiac energy metabolism, is inactivated by irradiation. The pro-inflammatory and pro-fibrotic TGFβ is activated by irradiation via SMAD-dependent and SMAD-independent pathways. The goal of this study was to investigate how altering the level of PPARα influences the radiation response of these signaling pathways. For this purpose, we used genetically modified C57Bl/6 mice with wild type (+/+), heterozygous (+/−) or homozygous (−/−) PPARα genotype. Mice were locally irradiated to the heart using doses of 8 or 16 Gy; the controls were sham-irradiated. The heart tissue was investigated using label-free proteomics 20 weeks after the irradiation and the predicted pathways were validated using immunoblotting, ELISA, and immunohistochemistry. The heterozygous PPARα mice showed most radiation-induced changes in the cardiac proteome, whereas the homozygous PPARα mice showed the least changes. Irradiation induced SMAD-dependent TGFβ signaling independently of the PPARα status, but the presence of PPARα was necessary for the activation of the SMAD-independent pathway. These data indicate a central role of PPARα in cardiac response to ionizing radiation.
中文翻译:

PPARα对于心脏中非经典TGFβ信号的辐射诱导激活是必需的
已知高剂量电离辐射会引起不良反应,例如心脏发炎和纤维化。已知转录调节剂PPARα和TGFβ参与这种辐射反应。PPARα是一种控制心脏能量代谢的抗炎转录因子,可通过辐射使其失活。促炎和促纤维化TGFβ通过SMAD依赖性和SMAD非依赖性途径的照射而被激活。这项研究的目的是研究改变PPARα的水平如何影响这些信号通路的辐射反应。为此,我们使用了具有野生型(+ / +),杂合型(+/-)或纯合型(-/-)PPARα基因型的基因修饰的C57Bl / 6小鼠。使用8或16 Gy的剂量将小鼠局部照射到心脏。对照进行假照射。辐照后20周,使用无标记蛋白质组学研究了心脏组织,并使用免疫印迹,ELISA和免疫组织化学验证了预测的途径。杂合的PPARα小鼠在心脏蛋白质组中显示出辐射诱导的变化最多,而纯合的PPARα小鼠显示出最少的变化。辐射诱导的SMAD依赖性TGFβ信号独立于PPARα状态,但是PPARα的存在对于激活SMAD非依赖性途径是必需的。这些数据表明PPARα在心脏对电离辐射的反应中起着核心作用。而纯合PPARα小鼠的变化最小。辐射诱导的SMAD依赖性TGFβ信号独立于PPARα状态,但是PPARα的存在对于激活SMAD非依赖性途径是必需的。这些数据表明PPARα在心脏对电离辐射的反应中起着核心作用。而纯合PPARα小鼠的变化最小。辐射诱导的SMAD依赖性TGFβ信号独立于PPARα状态,但是PPARα的存在对于激活SMAD非依赖性途径是必需的。这些数据表明PPARα在心脏对电离辐射的反应中起着核心作用。
更新日期:2018-03-24
中文翻译:

PPARα对于心脏中非经典TGFβ信号的辐射诱导激活是必需的
已知高剂量电离辐射会引起不良反应,例如心脏发炎和纤维化。已知转录调节剂PPARα和TGFβ参与这种辐射反应。PPARα是一种控制心脏能量代谢的抗炎转录因子,可通过辐射使其失活。促炎和促纤维化TGFβ通过SMAD依赖性和SMAD非依赖性途径的照射而被激活。这项研究的目的是研究改变PPARα的水平如何影响这些信号通路的辐射反应。为此,我们使用了具有野生型(+ / +),杂合型(+/-)或纯合型(-/-)PPARα基因型的基因修饰的C57Bl / 6小鼠。使用8或16 Gy的剂量将小鼠局部照射到心脏。对照进行假照射。辐照后20周,使用无标记蛋白质组学研究了心脏组织,并使用免疫印迹,ELISA和免疫组织化学验证了预测的途径。杂合的PPARα小鼠在心脏蛋白质组中显示出辐射诱导的变化最多,而纯合的PPARα小鼠显示出最少的变化。辐射诱导的SMAD依赖性TGFβ信号独立于PPARα状态,但是PPARα的存在对于激活SMAD非依赖性途径是必需的。这些数据表明PPARα在心脏对电离辐射的反应中起着核心作用。而纯合PPARα小鼠的变化最小。辐射诱导的SMAD依赖性TGFβ信号独立于PPARα状态,但是PPARα的存在对于激活SMAD非依赖性途径是必需的。这些数据表明PPARα在心脏对电离辐射的反应中起着核心作用。而纯合PPARα小鼠的变化最小。辐射诱导的SMAD依赖性TGFβ信号独立于PPARα状态,但是PPARα的存在对于激活SMAD非依赖性途径是必需的。这些数据表明PPARα在心脏对电离辐射的反应中起着核心作用。































 京公网安备 11010802027423号
京公网安备 11010802027423号