当前位置:
X-MOL 学术
›
Biochemistry
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Apo大肠杆菌cAMP受体蛋白的微状态的结构能态势和可塑性。
Biochemistry ( IF 2.9 ) Pub Date : 2020-01-10 , DOI: 10.1021/acs.biochem.9b00895 Rati Chkheidze , Wilfredo Evangelista 1 , Mark A White , Y Whitney Yin , J Ching Lee
Biochemistry ( IF 2.9 ) Pub Date : 2020-01-10 , DOI: 10.1021/acs.biochem.9b00895 Rati Chkheidze , Wilfredo Evangelista 1 , Mark A White , Y Whitney Yin , J Ching Lee
Affiliation
|
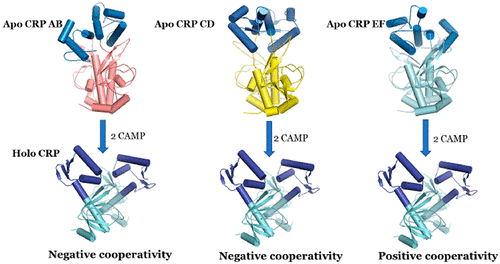
变构理论已发展成为现代能源景观集成理论,其主要特征是在平衡中存在多个微状态。由于其短暂的性质,微状态的性质没有很好地定义。载脂蛋白微状态的表征很重要,因为配体结合的微状态的特定复合物定义了生物学功能。链接生物学功能和结构所需的信息是载脂蛋白和全脂蛋白状态之间能量分布的定量相关性。我们使用了大肠杆菌cAMP受体蛋白(CRP)系统来测试集成理论中嵌入的功能,因为可以使用多种晶体载脂蛋白和全环结构。小角度X射线散射数据消除了三个载脂蛋白状态之一,但消除了另外两个。通过使用计算算法COREX / BEST,我们定义了载脂蛋白微状态之间潜在的能量格局差异。结合cAMP后,载脂蛋白CRP中残基之间的连接模式相同。apo CRP的微状态彼此之间的微小差异在于结构上的微扰,从而导致CRP各个域的能量分布发生变化。利用这些载脂蛋白状态之间能量分布的差异,我们计算了cAMP结合能,并将其与溶液的生物物理结果进行了比较。三种载脂蛋白微状态中只有一种产生的数据与溶液数据一致。嵌入各种载脂蛋白微态的能量态势变化的相对幅度显然定义了结合协同作用的最终结果。

"点击查看英文标题和摘要"
更新日期:2020-01-10

"点击查看英文标题和摘要"















































 京公网安备 11010802027423号
京公网安备 11010802027423号