Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Caveolin-1 gene therapy inhibits inflammasome activation to protect from bleomycin-induced pulmonary fibrosis.
Scientific Reports ( IF 3.8 ) Pub Date : 2019-12-23 , DOI: 10.1038/s41598-019-55819-y Xin Lin 1 , Michael Barravecchia 1 , R Matthew Kottmann 2 , Patricia Sime 2 , David A Dean 1
Scientific Reports ( IF 3.8 ) Pub Date : 2019-12-23 , DOI: 10.1038/s41598-019-55819-y Xin Lin 1 , Michael Barravecchia 1 , R Matthew Kottmann 2 , Patricia Sime 2 , David A Dean 1
Affiliation
|
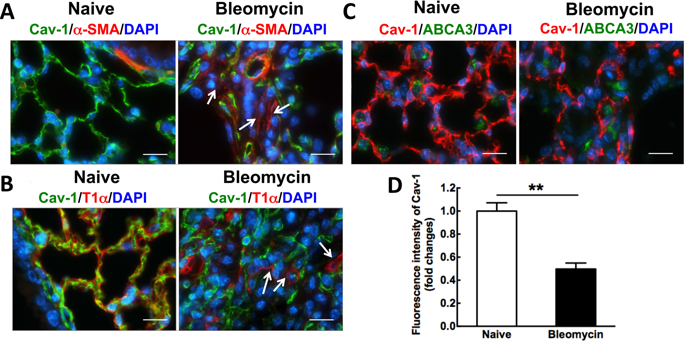
Idiopathic pulmonary fibrosis (IPF) is a devastating and fatal disease and characterized by increased deposition of extracellular matrix proteins and scar formation in the lung, resulting from alveolar epithelial damage and accumulation of inflammatory cells. Evidence suggests that Caveolin-1 (Cav-1), a major component of caveolae which regulates cell signaling and endocytosis, is a potential target to treat fibrotic diseases, although the mechanisms and responsible cell types are unclear. We show that Cav-1 expression was downregulated both in alveolar epithelial type I cells in bleomycin-injured mouse lungs and in lung sections from IPF patients. Increased expression of IL-1β and caspase-1 has been observed in IPF patients, indicating inflammasome activation associated with IPF. Gene transfer of a plasmid expressing Cav-1 using transthoracic electroporation reduced infiltration of neutrophils and monocytes/macrophages and protected from subsequent bleomycin-induced pulmonary fibrosis. Overexpression of Cav-1 suppressed bleomycin- or silica-induced activation of caspase-1 and maturation of pro-IL-1β to secrete cleaved IL-1β both in mouse lungs and in primary type I cells. These results demonstrate that gene transfer of Cav-1 downregulates inflammasome activity and protects from subsequent bleomycin-mediated pulmonary fibrosis. This indicates a pivotal regulation of Cav-1 in inflammasome activity and suggests a novel therapeutic strategy for patients with IPF.
中文翻译:

Caveolin-1基因疗法可抑制炎症小体活化,从而防止博来霉素诱导的肺纤维化。
特发性肺纤维化(IPF)是一种破坏性和致命性疾病,其特征是肺泡上皮损伤和炎性细胞积聚导致细胞外基质蛋白沉积增加,肺中形成疤痕。有证据表明,小窝蛋白1(Cav-1)是小窝蛋白的主要成分,调节细胞信号传导和内吞作用,是治疗纤维化疾病的潜在靶标,尽管其机制和负责任的细胞类型尚不清楚。我们显示在博莱霉素损伤的小鼠肺和IPF患者的肺切片中,肺泡上皮I型细胞中的Cav-1表达均被下调。在IPF患者中观察到IL-1β和caspase-1的表达增加,表明与IPF相关的炎症小体活化。使用经胸腔电穿孔法表达Cav-1的质粒的基因转移减少了嗜中性粒细胞和单核细胞/巨噬细胞的浸润,并防止了随后的博来霉素诱导的肺纤维化。Cav-1的过表达抑制了博莱霉素或二氧化硅诱导的caspase-1的激活以及pro-IL-1β的成熟以在小鼠肺和原代I型细胞中分泌裂解的IL-1β。这些结果表明,Cav-1的基因转移下调了炎性体的活性,并防止随后的博来霉素介导的肺纤维化。这表明Cav-1在炎性体活性中的关键调节作用,并为IPF患者提出了一种新颖的治疗策略。Cav-1的过表达抑制了博莱霉素或二氧化硅诱导的caspase-1的激活以及pro-IL-1β的成熟以在小鼠肺和原代I型细胞中分泌裂解的IL-1β。这些结果表明,Cav-1的基因转移下调了炎性体的活性,并防止随后的博来霉素介导的肺纤维化。这表明Cav-1在炎性体活性中起关键作用,并为IPF患者提出了一种新的治疗策略。Cav-1的过表达抑制了博莱霉素或二氧化硅诱导的caspase-1的激活以及pro-IL-1β的成熟以在小鼠肺和原代I型细胞中分泌裂解的IL-1β。这些结果表明,Cav-1的基因转移下调了炎性体的活性,并防止随后的博来霉素介导的肺纤维化。这表明Cav-1在炎性体活性中的关键调节作用,并为IPF患者提出了一种新颖的治疗策略。
更新日期:2019-12-23
中文翻译:

Caveolin-1基因疗法可抑制炎症小体活化,从而防止博来霉素诱导的肺纤维化。
特发性肺纤维化(IPF)是一种破坏性和致命性疾病,其特征是肺泡上皮损伤和炎性细胞积聚导致细胞外基质蛋白沉积增加,肺中形成疤痕。有证据表明,小窝蛋白1(Cav-1)是小窝蛋白的主要成分,调节细胞信号传导和内吞作用,是治疗纤维化疾病的潜在靶标,尽管其机制和负责任的细胞类型尚不清楚。我们显示在博莱霉素损伤的小鼠肺和IPF患者的肺切片中,肺泡上皮I型细胞中的Cav-1表达均被下调。在IPF患者中观察到IL-1β和caspase-1的表达增加,表明与IPF相关的炎症小体活化。使用经胸腔电穿孔法表达Cav-1的质粒的基因转移减少了嗜中性粒细胞和单核细胞/巨噬细胞的浸润,并防止了随后的博来霉素诱导的肺纤维化。Cav-1的过表达抑制了博莱霉素或二氧化硅诱导的caspase-1的激活以及pro-IL-1β的成熟以在小鼠肺和原代I型细胞中分泌裂解的IL-1β。这些结果表明,Cav-1的基因转移下调了炎性体的活性,并防止随后的博来霉素介导的肺纤维化。这表明Cav-1在炎性体活性中的关键调节作用,并为IPF患者提出了一种新颖的治疗策略。Cav-1的过表达抑制了博莱霉素或二氧化硅诱导的caspase-1的激活以及pro-IL-1β的成熟以在小鼠肺和原代I型细胞中分泌裂解的IL-1β。这些结果表明,Cav-1的基因转移下调了炎性体的活性,并防止随后的博来霉素介导的肺纤维化。这表明Cav-1在炎性体活性中起关键作用,并为IPF患者提出了一种新的治疗策略。Cav-1的过表达抑制了博莱霉素或二氧化硅诱导的caspase-1的激活以及pro-IL-1β的成熟以在小鼠肺和原代I型细胞中分泌裂解的IL-1β。这些结果表明,Cav-1的基因转移下调了炎性体的活性,并防止随后的博来霉素介导的肺纤维化。这表明Cav-1在炎性体活性中的关键调节作用,并为IPF患者提出了一种新颖的治疗策略。




















































 京公网安备 11010802027423号
京公网安备 11010802027423号