当前位置:
X-MOL 学术
›
J. Chem. Inf. Model.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
Computational Design of Myristoylated Cell-Penetrating Peptides Targeting Oncogenic K-Ras.G12D at the Effector-Binding Membrane Interface.
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2019-12-19 , DOI: 10.1021/acs.jcim.9b00690 Zhenlu Li , Matthias Buck
Journal of Chemical Information and Modeling ( IF 5.6 ) Pub Date : 2019-12-19 , DOI: 10.1021/acs.jcim.9b00690 Zhenlu Li , Matthias Buck
|
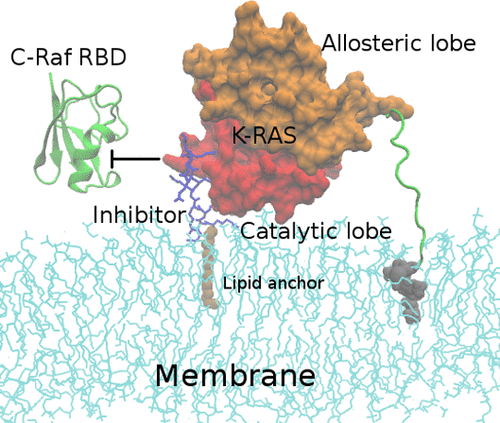
A number of small inhibitors have been developed in recent years to target the cancer-driving protein, K-Ras. In this study, we propose and design a novel way of targeting oncogenic K-Ras4B.G12D with myristoylated cell-penetrating peptides which become membrane-anchored and lock the protein into an inactive state. In all atom molecular dynamics simulations, such peptides associate with K-Ras4B exclusively at the effector-binding region, which, in turn, is expected to hinder the binding of downstream effector proteins (e.g., C-Raf). The myristoylated R9 (Arg9) peptide locks K-Ras4B.G12D into orientations that are unfavorable for effector binding. After breaking the cyclic structure and myristoylation, a cell-penetrating peptide cyclorasin 9A5, which was designed for targeting the Ras/Raf interface, is also found to be effective in targeting the Ras/membrane interface. The myristoylated peptides likely have high cell permeability because of their mixed cationic/hydrophobic character at the N-terminus, while simultaneously the subsequent multiple charges help to maintain a close association of the peptide with the K-Ras4B.G12D effector-binding lobe. Targeting protein-membrane interfaces is starting to attract attention very recently, thanks to our understanding of the signaling mechanism of an increased number of peripheral membrane proteins. The strategy used in this study has potential applications in the design of drugs against K-Ras4B-driven cancers. It also provides insights into the general principles of targeting protein-membrane interfaces.
中文翻译:

在效应子结合膜界面靶向致癌性K-Ras.G12D的肉豆蔻酰化细胞穿透肽的计算设计。
近年来,已开发出许多小抑制剂来靶向癌症驱动蛋白K-Ras。在这项研究中,我们提出并设计了一种新的方法,用肉豆蔻酰化的穿透细胞的肽靶向致癌的K-Ras4B.G12D,该肽会被膜锚定并将蛋白质锁定为非活性状态。在所有原子分子动力学模拟中,此类肽仅在效应子结合区与K-Ras4B缔合,从而有望阻碍下游效应子蛋白(例如C-Raf)的结合。肉豆蔻酰化的R9(Arg9)肽可将K-Ras4B.G12D锁定在不利于效应子结合的方向上。在破坏了环状结构和肉豆蔻酰化之后,设计了一种可穿透Ras / Raf界面的穿透细胞的肽环孢菌素9A5,还发现在靶向Ras /膜界面方面有效。由于其在N端具有混合的阳离子/疏水特性,肉豆蔻酰化的肽可能具有较高的细胞通透性,而同时随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。本研究中使用的策略在设计针对K-Ras4B驱动的癌症的药物中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。由于其在N端具有混合的阳离子/疏水特性,肉豆蔻酰化的肽可能具有较高的细胞通透性,而同时随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。由于其在N端具有混合的阳离子/疏水特性,肉豆蔻酰化的肽可能具有较高的细胞通透性,而同时随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。同时,随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。同时,随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。
更新日期:2020-01-07
中文翻译:

在效应子结合膜界面靶向致癌性K-Ras.G12D的肉豆蔻酰化细胞穿透肽的计算设计。
近年来,已开发出许多小抑制剂来靶向癌症驱动蛋白K-Ras。在这项研究中,我们提出并设计了一种新的方法,用肉豆蔻酰化的穿透细胞的肽靶向致癌的K-Ras4B.G12D,该肽会被膜锚定并将蛋白质锁定为非活性状态。在所有原子分子动力学模拟中,此类肽仅在效应子结合区与K-Ras4B缔合,从而有望阻碍下游效应子蛋白(例如C-Raf)的结合。肉豆蔻酰化的R9(Arg9)肽可将K-Ras4B.G12D锁定在不利于效应子结合的方向上。在破坏了环状结构和肉豆蔻酰化之后,设计了一种可穿透Ras / Raf界面的穿透细胞的肽环孢菌素9A5,还发现在靶向Ras /膜界面方面有效。由于其在N端具有混合的阳离子/疏水特性,肉豆蔻酰化的肽可能具有较高的细胞通透性,而同时随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。本研究中使用的策略在设计针对K-Ras4B驱动的癌症的药物中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。由于其在N端具有混合的阳离子/疏水特性,肉豆蔻酰化的肽可能具有较高的细胞通透性,而同时随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。由于其在N端具有混合的阳离子/疏水特性,肉豆蔻酰化的肽可能具有较高的细胞通透性,而同时随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。同时,随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。同时,随后的多个电荷有助于维持该肽与K-Ras4B.G12D效应子结合叶的紧密结合。由于我们对增加数量的外周膜蛋白的信号传导机制的了解,靶向蛋白-膜界面的研究最近开始引起人们的注意。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。这项研究中使用的策略在针对K-Ras4B驱动的癌症的药物设计中具有潜在的应用。它还提供了针对靶向蛋白质-膜界面的一般原理的见解。





















































 京公网安备 11010802027423号
京公网安备 11010802027423号