当前位置:
X-MOL 学术
›
Exp. Neurol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
NAD+ 前体通过 SIRT3 依赖机制调节缺血后线粒体断裂和活性氧的产生。
Experimental Neurology ( IF 4.6 ) Pub Date : 2019-12-11 , DOI: 10.1016/j.expneurol.2019.113144
Nina Klimova 1 , Adam Fearnow 2 , Aaron Long 2 , Tibor Kristian 3
Experimental Neurology ( IF 4.6 ) Pub Date : 2019-12-11 , DOI: 10.1016/j.expneurol.2019.113144
Nina Klimova 1 , Adam Fearnow 2 , Aaron Long 2 , Tibor Kristian 3
Affiliation
|
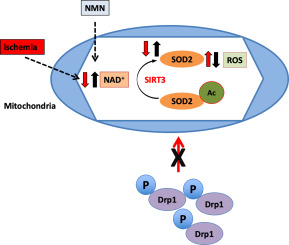
全脑缺血消耗脑组织 NAD+,这是线粒体和细胞代谢的重要辅助因子,导致生物能量学失败和细胞死亡。可以通过使用烟酰胺单核苷酸 (NMN) 来补充缺血后的 NAD+ 水平,NMN 作为 NAD+ 合成的前体。我们已经证明,NMN 给药显示出对缺血性脑损伤的显着保护,并抑制缺血后海马线粒体断裂。为了了解 NMN 诱导的线粒体动力学和神经保护调节机制,我们使用了我们的转基因小鼠模型,这些模型在神经元中表达靶向黄色荧光蛋白的线粒体 (mito-eYFP) 和敲除线粒体 NAD+ 依赖性脱乙酰酶 sirt3 基因 (SIRT3KO) 的小鼠. 缺血性损伤后,线粒体 NAD+ 水平被耗尽,导致线粒体蛋白乙酰化增加、高活性氧 (ROS) 产生和线粒体过度断裂。施用单剂量 NMN 可使海马线粒体 NAD+ 池、蛋白质乙酰化和 ROS 水平正常化。这些变化取决于 SIRT3 活性,这已使用 SIRT3KO 小鼠得到证实。缺血诱导关键线粒体抗氧化酶超氧化物歧化酶 2 (SOD2) 乙酰化增加,导致其活性受到抑制。这在 NMN 处理后逆转,然后减少 ROS 的产生和抑制线粒体断裂。具体来说,我们发现线粒体裂变蛋白 pDrp1(S616) 与神经元线粒体的相互作用在 NMN 治疗的缺血小鼠中受到抑制。因此,我们的数据提供了线粒体 NAD+ 代谢、ROS 产生和线粒体断裂之间的新联系。使用 NMN 靶向这些机制可能代表一种治疗急性脑损伤和神经退行性疾病的新治疗方法。

"点击查看英文标题和摘要"
更新日期:2019-12-17

"点击查看英文标题和摘要"

































 京公网安备 11010802027423号
京公网安备 11010802027423号