当前位置:
X-MOL 学术
›
ChemistrySelect
›
论文详情
Our official English website, www.x-mol.net, welcomes your feedback! (Note: you will need to create a separate account there.)
类胶原三螺旋结构的形成,稳定性和自组装行为:Ser,Ala和Arg / Glu的作用
ChemistrySelect ( IF 1.9 ) Pub Date : 2019-12-05 , DOI: 10.1002/slct.201903500 Feiyi Shu 1 , Chun Dai 2 , Haibo Wang 1 , Chengzhi Xu 1 , Benmei Wie 1 , Juntao Zhang 1 , Yuling Xu 1 , Lang He 1 , Sheng Li 1
ChemistrySelect ( IF 1.9 ) Pub Date : 2019-12-05 , DOI: 10.1002/slct.201903500 Feiyi Shu 1 , Chun Dai 2 , Haibo Wang 1 , Chengzhi Xu 1 , Benmei Wie 1 , Juntao Zhang 1 , Yuling Xu 1 , Lang He 1 , Sheng Li 1
Affiliation
|
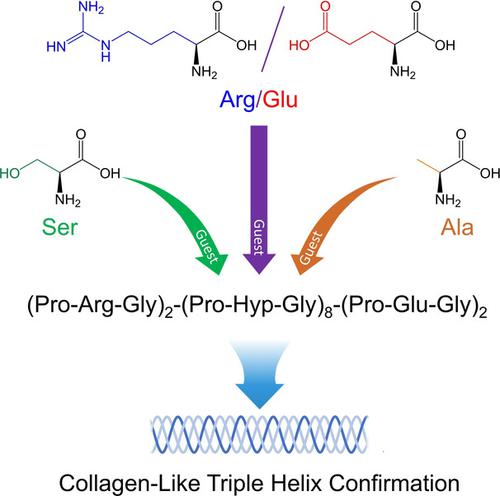
α链的独特序列是胶原三重螺旋的结构基石,决定了其构象和分子行为。在这项研究中,设计了具有不同序列特征的类胶原蛋白肽,以阐明Ser(极性残基),Ala(非极性残基)和Arg / Glu(可电离残基)在形成,动力学和稳定性方面的作用。三重螺旋及其自组装行为。我们发现(Gly-Hyp-Pro)n中引入了其他常见氨基酸导致三重螺旋构象的形成速率和稳定性以及自组装成高阶结构的程度不同程度的降低。Ser的引入对这些过程表现出最大的有害作用,其次是Arg / Glu和Ala,带有Ser的胶原蛋白样肽无法形成热力学稳定的三螺旋构象,并丧失了进一步自我组装的能力。Arg / Glu促进了胶原样肽的自组装,而静电相互作用和氢键是类似于天然胶原的周期性有序结构自组装的关键。丙氨酸的疏水相互作用在某种程度上也促进了自组装,但是由于缺乏疏水相互作用的方向性,长程有序结构的形成受到了负面影响。

"点击查看英文标题和摘要"
更新日期:2019-12-05

"点击查看英文标题和摘要"












































 京公网安备 11010802027423号
京公网安备 11010802027423号