当前位置:
X-MOL 学术
›
Nat. Struct. Mol. Biol.
›
论文详情
Our official English website, www.x-mol.net, welcomes your
feedback! (Note: you will need to create a separate account there.)
InsP6 binding to PIKK kinases revealed by the cryo-EM structure of an SMG1-SMG8-SMG9 complex.
Nature Structural & Molecular Biology ( IF 12.5 ) Pub Date : 2019-12-02 , DOI: 10.1038/s41594-019-0342-7 Yair Gat 1 , Jan Michael Schuller 1 , Mahesh Lingaraju 1 , Elisabeth Weyher 2 , Fabien Bonneau 1 , Mike Strauss 3, 4 , Peter J Murray 5 , Elena Conti 1
Nature Structural & Molecular Biology ( IF 12.5 ) Pub Date : 2019-12-02 , DOI: 10.1038/s41594-019-0342-7 Yair Gat 1 , Jan Michael Schuller 1 , Mahesh Lingaraju 1 , Elisabeth Weyher 2 , Fabien Bonneau 1 , Mike Strauss 3, 4 , Peter J Murray 5 , Elena Conti 1
Affiliation
|
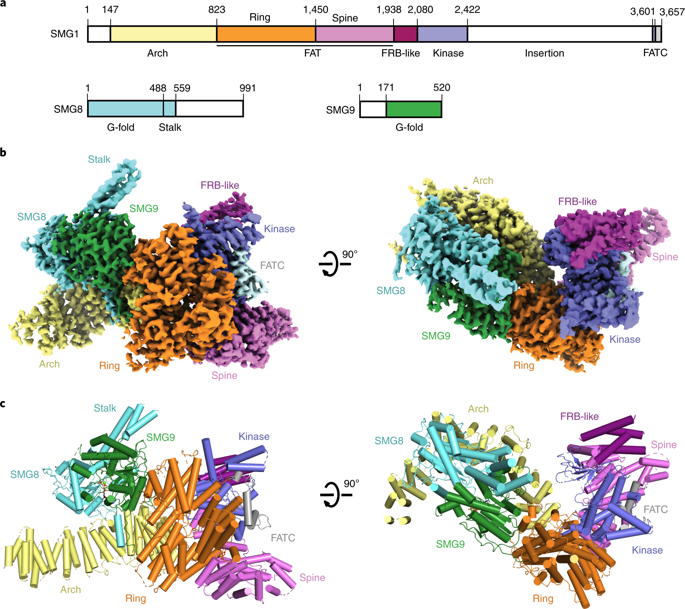
We report the 3.45-Å resolution cryo-EM structure of human SMG1-SMG8-SMG9, a phosphatidylinositol-3-kinase (PI(3)K)-related protein kinase (PIKK) complex central to messenger RNA surveillance. Structural and MS analyses reveal the presence of inositol hexaphosphate (InsP6) in the SMG1 kinase. We show that the InsP6-binding site is conserved in mammalian target of rapamycin (mTOR) and potentially other PIKK members, and that it is required for optimal in vitro phosphorylation of both SMG1 and mTOR substrates.
中文翻译:

SMG1-SMG8-SMG9 复合物的低温电磁结构揭示了 InsP6 与 PIKK 激酶的结合。
我们报告了人类 SMG1-SMG8-SMG9 的 3.45-Å 分辨率冷冻电镜结构,这是一种磷脂酰肌醇-3-激酶 (PI(3)K) 相关蛋白激酶 (PIKK) 复合物,对信使 RNA 监测至关重要。结构和 MS 分析揭示了 SMG1 激酶中肌醇六磷酸 (InsP6) 的存在。我们表明 InsP6 结合位点在哺乳动物雷帕霉素靶蛋白 (mTOR) 和可能的其他 PIKK 成员中是保守的,并且它是 SMG1 和 mTOR 底物的最佳体外磷酸化所必需的。
更新日期:2019-12-02
中文翻译:

SMG1-SMG8-SMG9 复合物的低温电磁结构揭示了 InsP6 与 PIKK 激酶的结合。
我们报告了人类 SMG1-SMG8-SMG9 的 3.45-Å 分辨率冷冻电镜结构,这是一种磷脂酰肌醇-3-激酶 (PI(3)K) 相关蛋白激酶 (PIKK) 复合物,对信使 RNA 监测至关重要。结构和 MS 分析揭示了 SMG1 激酶中肌醇六磷酸 (InsP6) 的存在。我们表明 InsP6 结合位点在哺乳动物雷帕霉素靶蛋白 (mTOR) 和可能的其他 PIKK 成员中是保守的,并且它是 SMG1 和 mTOR 底物的最佳体外磷酸化所必需的。































 京公网安备 11010802027423号
京公网安备 11010802027423号